CTLA-4+PD-1,天演药业一项临床试验获FDA批准
B村客官$天演药业(ADAG)$ 宣布,美国食品药品监督管理局 (FDA) 已批准ADG116 与帕博利珠单抗联合疗法的Ib/II临床试验申请。该全球试验将于美国及亚太地区多个临床中心对晚期/转移性实体瘤患者进行评估。
该项试验预计于2022年初进行首例患者给药,旨在评估安全性和耐受性,确定最大耐受剂量,并评估ADG116与帕博利珠单抗联合用药的初步疗效。
CTLA-4和PD-1被认为是免疫系统的两个重要检查点蛋白,它们分别通过影响不同类型的T细胞来抑制抗肿瘤免疫攻击,已成为肿瘤免疫治疗的基石靶点。近年越来越多的研究表明,针对CTLA-4靶点的药物开发和疗效提升需要强化清除肿瘤微环境中的调节性T细胞。
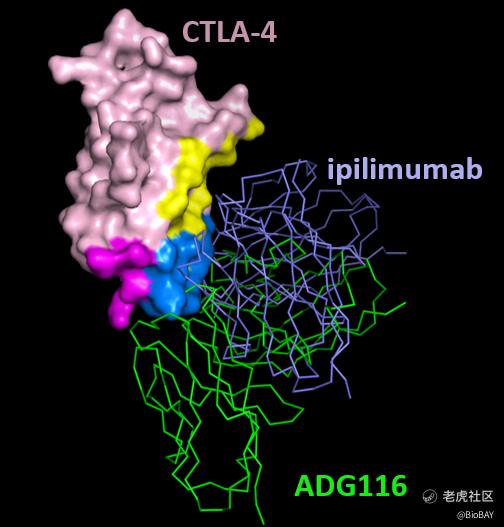
ADG116是一款由天演药业原创的新表位抗体NEObody™ 平台技术生成的靶向 CTLA-4 的独特保守表位的单克隆抗体,通过高效清除肿瘤微环境中的调节性T细胞并柔性阻断CTLA-4配体结合而激活T细胞,旨在增加有效性的同时改善产品安全性,有望克服现有的抗CTLA-4疗法存在的安全性问题。目前已获得国家药品监督管理局(NMPA)新药临床试验(IND)申请批准,用于单药治疗试验。预计今年下半年公布ADG-116单药治疗持续剂量递增的结果。(相关阅读:B村资讯 | 天演药业公布ADG116最新临床进展,有潜力克服CTLA-4局限性)
天演药业联合创始人、首席执行官兼董事长罗培志博士表示:“ FDA批准此临床试验是天演抗 CTLA-4 疗法开发计划中的一个重要里程碑,标志着我们对ADG116 与抗 PD-1疗法联合用药进行评估的重要进展。凭借新表位抗体 NEObody™技术,ADG116有望克服抗 CTLA-4 疗法现存的安全性问题,从而实现更好的临床获益。而对ADG116与帕博利珠单抗联用的探索旨在发挥CTLA-4/PD-1 的双重阻断作用,平衡安全性和有效性以释放该联合疗法作为癌症治疗基石的潜力。”
免责声明:上述内容仅代表发帖人个人观点,不构成本平台的任何投资建议。



