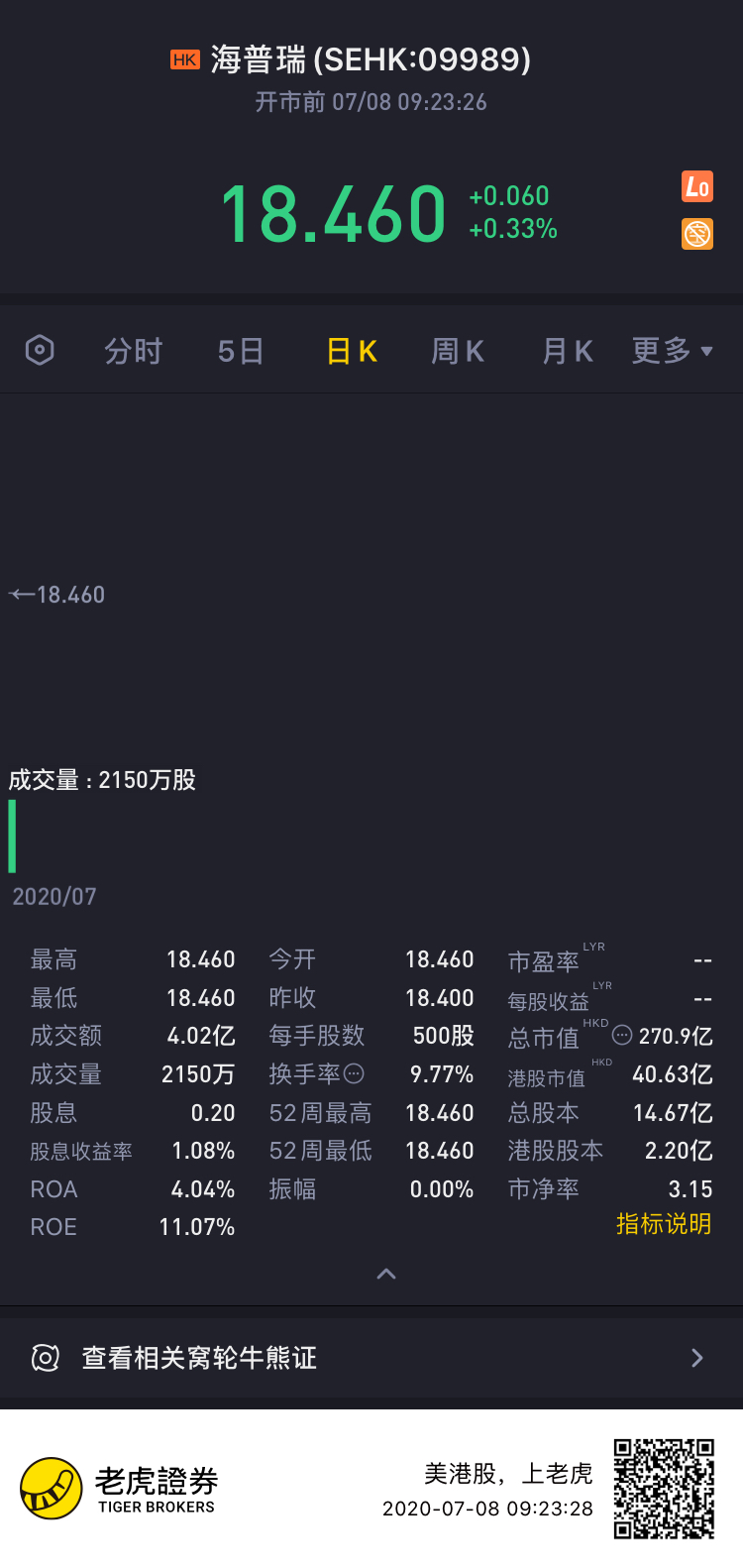
7月8日讯,海普瑞今日首日上市高开0.33%报18.46港元,盘前成交4.02亿港元,最新总市值408亿港元。该股IPO价格为18.4港元,认购倍数69.21倍。据悉,本次赴港上市,海普瑞得到了OrbiMed Funds、AVICT、欧万达基金、3W、Anlan Funds等国际化基石投资者的支持,合计认购海普瑞4630.75万发售股份,约8.52亿港元。
延伸阅读:
海普瑞赴港上市 开启“A+H”双平台融资新篇章
7月7日早间,深圳市海普瑞药业集团股份有限公司(以下简称“海普瑞”,002399.SZ,09989.HK)发布了《关于境外上市外资股(H股)配发结果的公告》。这意味着,海普瑞将于明日(7月8日)正式登陆H股,并将发行2.2亿股,发售价定为每股18.40港元,全球发售所得款项净额约为38.06亿港元。
据悉,本次赴港上市,海普瑞得到了OrbiMed Funds、AVICT、欧万达基金、3W、Anlan Funds等国际化基石投资者的支持,合计认购海普瑞4630.75万发售股份,约8.52亿港元。同时,对于海普瑞本次招股,参与公开发售的投资者也表现出极大的的热情,认购首日即得到超7.7倍认购,截至6月30日认购结束,海普瑞共录得69.21倍的超额认购。
H股发行认购火热充分体现了投资者对海普瑞综合实力的认可。据了解,海普瑞是国内肝素产业的领军企业,也是国内为数不多的获得美国FDA和欧盟CEP双认证的制药企业。目前,该公司已经建立起完备的肝素产业价值链,并已成为中国最大、全球第三大依诺肝素钠制剂生产及销售商,在全球依诺肝素市场占据了领先的地位。
近日,海普瑞Inhixa品牌依诺肝素制剂在瑞士获批上市,这是继2019年该公司在欧洲市场占有率高达17.8%后,进一步推进欧洲市场全覆盖的重要里程碑事件。从全球范围来看,海普瑞的依诺肝素制剂已在35个国家获批,并在19个国家销售。与此同时,该公司有计划地持续扩张全球肝素制剂市场占有率,力争成为全球肝素行业的领导者。
此外,海普瑞官网消息显示,海普瑞坪山产业园已正式获得EMA批准,成为Inhixa所需依诺肝素钠原料药生产地,待其产能达产后,有望全部投向公司依诺肝素钠制剂的生产和销售,不仅可以为海普瑞实现欧洲全覆盖提供充足的产品保障,也为其实现全球市场扩张的战略提供了产能支持。
值得一提的是,近期海普瑞的重点创新药品种RVX-208临床试验进程也获得了重大突破性进展,美国FDA已经批准了RVX-208接下来III期关键性的临床试验方案,且新的方案以对公司较有利的方式制定,预计将加速RVX-208未来的商业化进程,有望早日为全球患者带来福音。
除了RVX-208外,海普瑞还有多个创新药在研,其中,AR-101正处于II期全球试验阶段;AR-301正在开展国际多中心III期临床试验,还获得FDA授予的快速通道审批资格认定及EMA授予的罕用药资格认定;Oregovomab已经完成IIb期临床,即将启动全球III期临床试验,并已获得欧盟EMA和美国FDA孤儿药资格认定,预计将加速该品种的开发和审评,提早进入商业化阶段。
本次H股上市对海普瑞来讲意义非凡,相信有了充足的资本加持,海普瑞可以进一步深化跨国运营战略,拓展海外市场版图,并借助H股平台扩大国际影响力,树立优秀的国际形象,在不远的未来实现估值与业绩双提升。
原文综合自证券市场周刊