盲盒开出王炸:肺癌领域大变天
第三代EGFR-TKI可能正在遭遇最强狙击。
奥希替尼在2024H1的销售依旧强劲,全球销售额为32亿美元,排在所有抗肿瘤药物的第五位。
奥希替尼的专利期到2032年以后,但带来最大的冲击并不是me-too甚至me-better的同类药物们,更是来自于更前沿的对手。
近日,强生的 EGFR-MET 双抗Amivantamab(埃万妥单抗) 在最新的三期临床研究中成功头对头击败了奥希替尼,这个可能意味着以EGFR双抗为首的新一代药物即将崛起。
市场投资者在过去常常思考奥希替尼耐药后的机会,如今连带作为EGFR-TKI的奥希替尼市场都有可能遭遇新一代疗法的冲击,不仅是埃万妥单抗,更多新型ADC疗法也在冲击这个市场,肺癌领域的格局变天将至。
01 击败肺癌药王的迭代者
据资料显示,非小细胞肺癌占肺癌适应症比例大约在85%左右。表皮生长因子受体(EGFR)突变亚型,在中国NSCLC人群中占到了40%~50%,独占鳌头。国内过去大量同肺癌斗争的研发历史,大部分是EGFR-TKI小分子靶向药迭代的历史,过去贝达药业一代靶向药埃克替尼带领了中国创新药走过了蛮荒时代,视角拉倒近十年,以奥希替尼为代表的第三代把靶向药横空出世,横扫肺癌适应症市场,迅速完成了从后线到前线用药的迭代。
2015年11月,奥希替尼获美国FDA批准在美国首先上市。其在国内于2017年上市,并在国内纳入医保。2019年,其正式在国内获批用于一线治疗EGFR突变阳性局部晚期或转移性NSCLC。在国内,它2023年全年销售额达到了70亿元。作为对比,瀚森医药的阿美替尼2023年销售额为35亿元,艾力斯的伏美替尼为20亿元左右,奥希替尼遥遥领先。
不过,在肺癌领域有两个关键的未来走向问题。一个是奥希替尼耐药后的后线治疗,一个是未来小分子靶向药的联用问题。
关于第一点,现在不管是国内还是国外,都在寻求突破。国内方面,最近几日上市的同源康医药,其核心管线——氘代小分子TKI抑制剂TY-9591已经在2022年开启了临床III期——头对头奥希替尼,剑指肺癌药王。与奥希替尼相比,TY-9591的显著差别之一在于药代动力学特性,稳定性更强,同时能显著减少有毒代谢物AZD5104的产生(降低60%),毒副作用相应减少,同时显著增加TY-9591体内暴露量(比奥希替尼高73%)。
TY-9591将会于2025年递交上市申请。该药被视为奥希替尼耐药后进行后线治疗的新希望。
当然,除了TY-9591这种算是四代EGFR-TKI之外,奥希替尼也在寻求不同的方式来解决耐药性问题,包括筛选不同的耐药突变基因类型进行相应的小分子抑制剂的联用,以图逆转奥希替尼的耐药问题。
但是,如果把格局放大,耐药后的后线治疗,也许可以通过与免疫亦或者ADC疗法一起解决。小分子和新一代的免疫疗法联用,不仅可以解决耐药问题,还可以直接拓展到前线用药,不仅大大增加双抗的市场空间,而且顺利让双抗和三代TKI抑制剂成为黄金搭档,为NSCLC带来新的疗法。
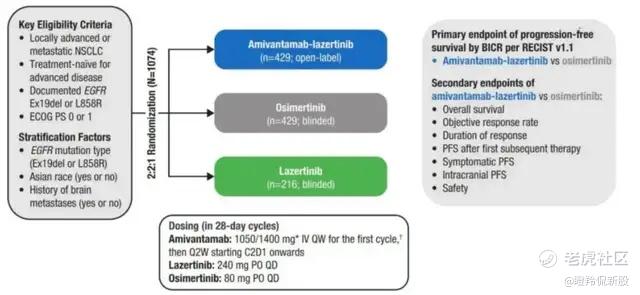
强生的Amivantamab(埃万妥单抗)是EGFR-MET的双特异性抗体,它与另一种第三代靶向药拉泽替尼(韩国柳韩洋行研发、强生生产)在MARIPOSA这全球多中心的三期临床中与奥希替尼展开了头对头对决。
这场临床试验中,1074名患者以2:2:1随机分配,429名患者用双抗和拉泽替尼联用,429名患者用拉泽替尼,另外216名患者用奥希替尼。研究的主要终点是埃万妥单抗+拉泽替尼组与奥希替尼组的无进展生存期(PFS)。
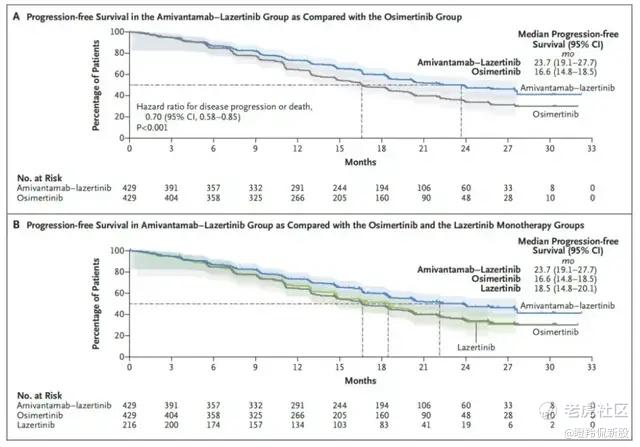
如图所示,ASCO大会上发布了主要临床研究结果。在最后的试验主要终点上,可以看到PFS上较为明显的曲线差异。埃万妥单抗+拉泽替尼组的中位PFS为23.7个月,而奥希替尼组为16.6个月,18个月和24个月PFS率分别为60% vs 48%和48% vs 34%。
之后,在近日的WCLC 2024 大会上,强生公布了之后的随访OS数据,更加体现了联用疗法的显著优势。Amivantamab+拉泽替尼组的中位OS还未达到,而奥希替尼组的中位OS为37.3个月。而在24个月时,Amivantamab+拉泽替尼组和奥希替尼组的存活率分别为75%和70%;36个月时的相应值分别为61%和53%。
鉴于该疗法的显著优势,8月19日,FDA批准amivantamab联合拉泽替尼联合用于具有表皮生长因子受体(EGFR)外显子19缺失或外显子21 L858R置换突变的局部晚期或转移性NSCLC成人患者的一线治疗。
多抗联用的三代TKI抑制剂迭代单一TKI抑制剂的时代,就此到来。
02 双抗——肺癌治疗的新时代
虽然,强生的埃万妥的单抗这款药已经上市好几年(2021年5就获得FDA加速批准),用于EGFR 20外显子插入突变NSCLC成人患者的铂类治疗进展后的治疗,在当时是全球首款获批用于治疗实体瘤的双抗,也是基于其II期临床不错的研究数据,但这几年的商业化成绩一直不算特别惊艳(适应症较小的问题)。
但强生却对其非常有信心,2023年12月,强生在投资者日上表示:埃万妥单抗在肺部疾病组合的销售峰值为50亿美元,在一线的市占率剑指 50%。如今在其头对头击败奥希替尼,以其强生在全球的商业化渠道布局,达到这个数字已经不是困难的事情。
当然,现在这个数据已经有了这么大的确定性之后,也许我们应该把眼光从面前的轨道拓宽到整个市场的旷野,看到现在市面上双抗对三代靶向药在NSCLC市场的冲击力。
其中最值得一提的,自然是康方的AK112。作为PD-1和VEGF双抗,AK112主打的就复合免疫疗法。今年5月,它的临床III期数据公布,也伴随着股价的大起大落,最后结果大多数投资者也看到,它获得了化疗联用后线治疗非小细胞肺癌后,又迅速在国际多中心III期临床头对头中击败了药王K药,不仅在5月底光速获批后线治疗NSCLC,更在今年七月底直接获批一线治疗NSCLC。
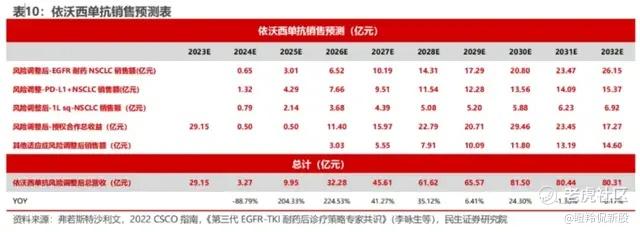
康方的销售模型可以根据之前民生证券研究所的model进行拆解。最后的销售额预测上,NSCLC耐药的后线适应症销售峰值可以达到26.15亿元,而其总的销售峰值,将在2030年达到81.5亿元。但是,该销售额峰值都进行了研发成功系数的折价,而现在该药临床III期成功已经成为了确定事件,如果不进行折价,那么其2030年的销售峰值将达到87.4亿元。
02 多样化治疗是未来
对于NSCLC而言,从前的三代靶向药单药治疗大大延续了患者的生存期,但治疗药物种类较为单一。而在未来,肺癌领域靶点一方面需要拓宽,EGFR突变的人群在中国只有一半不到,剩下的患者也需要活下去的机会。免疫治疗和三代靶向药一起使用,确实能打出不错的战绩,而新型ADC的出现,也为肺癌治疗领域的格局变化带来了更多的变数。
Her2、Trop2、Her3、c-Met这几个热门靶点的ADC,目前在肺癌领域的进展颇丰。
NSCLC患者中HER2突变、HER2扩展、HER2过表达的发生率分别为1%~6.7%、2%~22%、7.7%~23%。靶向HER2的ADC是最早开始商业化的靶点之一,也是目前商业化最成功的靶点。当时DS-8201在遇到营收的平台期后能够继续爬坡,便是有赖于2022年NSCLC适应症的获批。
虽然HER2对于NSCLC来说可能突变概率并不如EGFR那么高,但ADC药物的靶点在不断拓宽,对不同突变的NSCLC,总有一款ADC能够精准狙击。
Telisotuzumab Vedotin(ABBV-399)便是针对肺癌ADC中的rising star之一。ABBV-399主要靶向c-MET,与强生双抗的其中一个抗体相同,c-Met蛋白过表达在NSCLC中比例为13.7%-63.7%,靶向药经治的EGFR突变的晚期非小细胞肺癌患者中c-Met蛋白过表达的发生率为30.4%~37.0%,并且c-Met蛋白过表达与预后不良相关(数据源于2022年版非小细胞肺癌MET临床检测中国专家共识)。
2022年1月,ABBV-399被FDA授予了突破性疗法资格,用于治疗晚期或转移性铂类治疗后进展的c-Met高表达EGFR野生型非鳞状NSCLC患者。其III期M18-868临床研究预计将于2025年6月完成。
根据其2023年11月底宣布的ABBV-399单臂II期LUMINOSITY试验的结果,在可评估疗效的122人中,非鳞状EGFR野生型组的ORR为36.5%,c-Met高组的ORR则达到了52.2%。
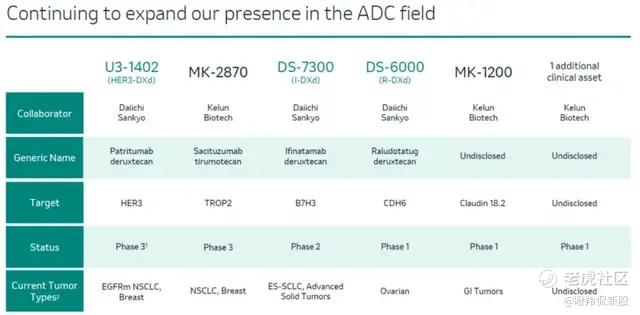
当然,ADC领域的治疗,自然少不了这个ADC领域的先驱第一三共。目前,其在肺癌领域值得期待的管线为U3-1402,目前已经开始了全球多中心临床试验。UE-1402的靶点为HER3,HER3 在约 83% 的原发性 NSCLC 中表达,也是NSCLC中难得的优质靶点。
而MK-2870(即科伦博泰的skb264)的靶向则是trop2,可以说是目前ADC领域第二火热的靶点,该靶点的天花板不会比HER2更低,可以布局的适应症更加多样化。2023年10月,其启动了针对NSCLC的全球III期临床。
结语:非小细胞肺癌的治疗这二十年,是从单一化走向多样化,从单药走向联用的过程。过去第一代TKI抑制剂的出现打破了化疗的困局,而后在TKI抑制剂上不断迭代,出现了第二代和第三代抑制剂,再后来是PD-1的出现让免疫疗法进入了肺癌治疗。
现在,早已经不是小分子抑制剂垄断肺癌市场的时代,这个时代有多抗,有ADC,有许多联用的排列组合,它们互相交织成为治疗矩阵,共同为肺癌患者治疗提供了更多可能,也为这个市场打开了更加多元化空间。 $同源康医药-B(02410)$ $强生(JNJ)$ $科伦博泰生物-B(06990)$
免责声明:上述内容仅代表发帖人个人观点,不构成本平台的任何投资建议。