肿瘤慢病化,你准备好了吗?
据《柳叶刀•肿瘤学》数据显示,近10年肿瘤患者五年生存率提升了10%[1],这意味着肿瘤在一定程度上得到有效控制,肿瘤治疗逐步进入慢病化管理时代。新时代下,理想的肿瘤创新药开发策略不仅要尽可能延长患者生存周期,更应该考虑患者的生活质量和避免复发和转移。CDE近日发布的《以临床价值为导向的抗肿瘤药物临床研发指导原则》(征求意见稿)为肿瘤慢病化时代的药物研发给出了具体的科学指导方案,强调对疾病的理解,倾听患者的声音。肿瘤慢病化赛道能量蓄积被官方加持,市场前景广阔,投资人你准备好了吗?
在近期众多向香港联交所提交上市申请的公司中,我们发现了这样一家专注肿瘤慢病化领域,致力于“帮助肿瘤患者活得更久更好”的生物医药企业——3D Medicines Inc.(思路迪医药)。据招股书显示,思路迪医药是一家领先的创新、接近商业化阶段的生物医药公司,具备全球研究与开发能力。因应肿瘤治疗慢病化的未来趋势,其致力于开发及商业化具有差异化临床表现的新一代肿瘤免疫治疗药物。秉承「帮助延长肿瘤患者的生存时间,改善患者生活质量」的理念。
01临床价值:差异化与“First in class”双轮驱动
据了解,围绕肿瘤治疗慢病化的趋势,思路迪医药已战略性地制定候选药物管线前瞻计划。在该领域市场建立起领先地位,拥有包含12款候选药物的强大管线,如:恩沃利单抗注射液(Envafolimab)、Galinpepimut-S (3D189)、3D229(GAS6/AXL)、3D011(TKI前药)、3D197(CD47)、3D057(CD3xPD-L1)、3D062(KRAS)等。从中,我们不难看出“差异化”和“创新”已成为公司开发的灵魂。
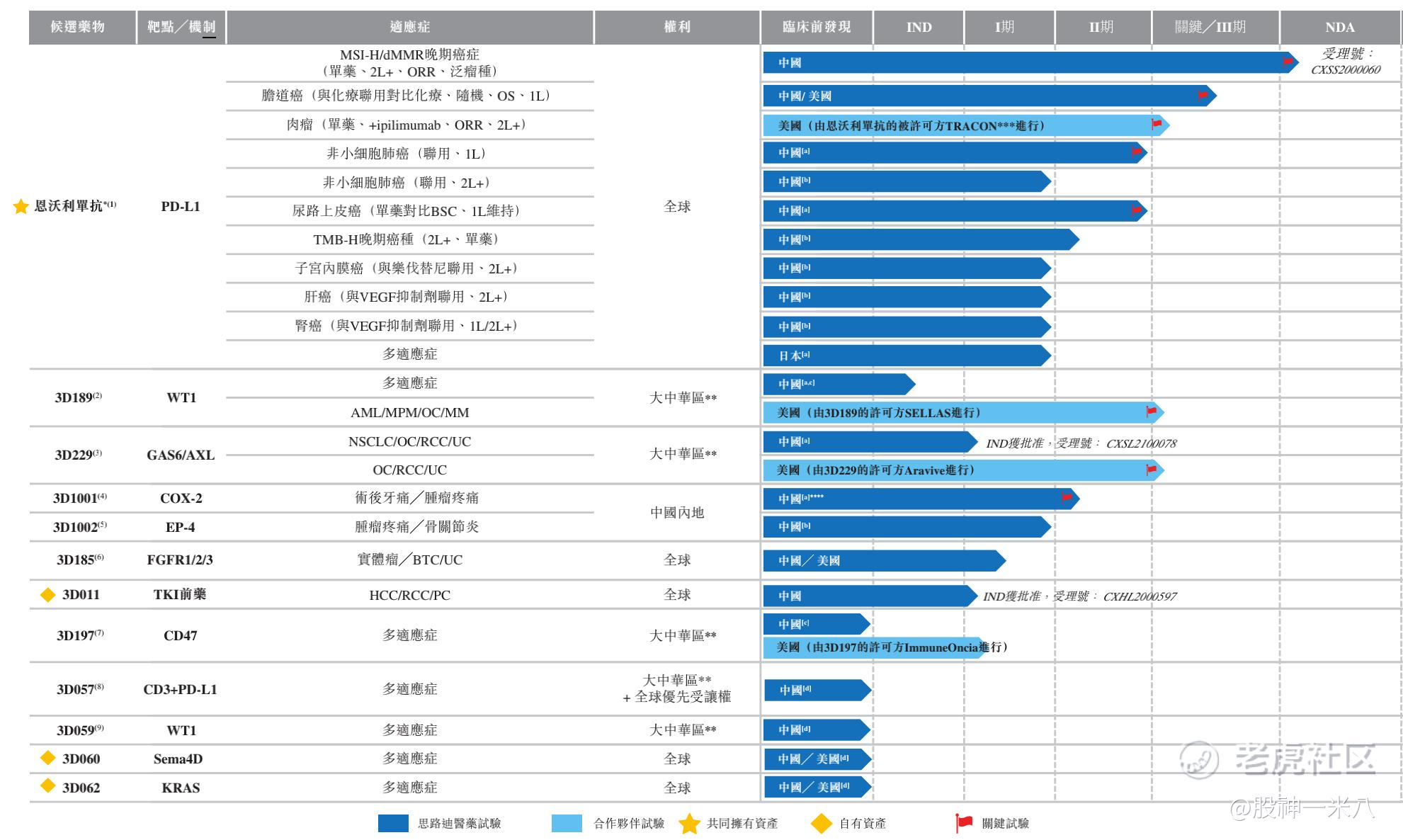
2020年12月17日,重组人源化PD-L1单域抗体恩沃利单抗注射液的新药上市申请(NDA)获得国家药品监督管理局(NMPA)正式受理,适应症为标准治疗失败的MSI-H/dMMR 晚期实体瘤。2021年1月,上市申请被NMPA药品审评中心(CDE)纳入优先审评,有望成为全球首个PD-(L)1皮下制剂,中国首个国产的标准治疗失败的MSI- H/dMMR泛瘤肿晚期实体瘤PD-(L)1抑制剂。
在PD-(L)1赛道竞争已白热化的当下,差异化是突围的关键。目前国内外已上市及在研的PD-(L)1抗体全部为静脉注射,给药时间从几十分钟到几个小时不等。再加上肿瘤免疫治疗长期给药的情况,这对于身体状态不佳的肿瘤患者十分痛苦,漫长的用药时间和多次静脉注射引起的输注反应,也加重了肿瘤患者的负担。恩沃利单抗注射液为PD-L1单域抗体Fc融合蛋白,相比其他PD-(L)1抗体,可在30秒钟完成给药,具备注射量小、常温下稳定、注射部位限制少等特点。恩沃利单抗由康宁杰瑞自主研发,在2016年2月,双方强强联合达成战略合作,思路迪医药开启恩沃利单抗全球肿瘤领域的临床开发和商业化。[2]
凭借着对国际医药市场深刻理解和高效的临床执行力,思路迪医药于2017年在美国、中国、日本三地同步开展针对多个肿瘤适应症临床试验,在美国进行的首次人体试验,至今已有近千名患者入组。基于前期研究数据及生物标记物MSI-H/dMMR的肿瘤患者能在免疫治疗中显示显著的疗效获益[3,4]和泛癌种特性,2018年8月该公司启动了中国第一个针对MSI-H/dMMR泛瘤肿晚期实体瘤患者注册性临床试验。
在这项由北京大学肿瘤医院沈琳教授牵头的关键性II期临床研究中,恩沃利单抗治疗二线以上患者的客观缓解率(ORR)为42.7%,中位无进展生存期为11.1个月,12个月总生存率为74.6%。在安全性上,免疫相关性不良事件(irAE)发生率和发生情况与同类产品相似。相较KEYNOTE-164、KEYNOTE-158和CHECKMATE-142试验数据,恩沃利单抗注射液疗效与同类产品(Keytruda和Opdivo)展现出高度一致。该研究结果于国际知名医学期刊《Journal of Hematology & Oncology》(影响因子17.388)在线发表。
目前该药物也正在拓展非小细胞肺癌、肝细胞癌、胆道癌、软组织肉瘤、尿路上皮癌、TMB-H、子宫内膜癌、肾细胞癌等多种肿瘤适应症。美国FDA于2020年1月18日授予恩沃利单抗治疗晚期胆道癌的孤儿药资格。
据记者了解,公司一直在致力于进一步提高恩沃利单抗的用药便捷性和患者覆盖度,并且在近日已取得亮眼的阶段性成绩。2021年5月,国际知名医学期刊《The Oncologist》(影响因子5.025)在线发表恩沃利单抗美国I期临床数据。该研究的药代动力学模拟结果支持对恩沃利单抗300mg Q3W或400mg Q4W的固定剂量给药方案进行临床开发,这意味着未来有望实现每三周或每四周的用药方案。
思路迪的肿瘤新药的研发不仅取决于候选化合物的筛选、临床前研究,还需仔细考量临床的需求,特别是在最初立项和计划临床试验之际,企业只有充分理解患者需求和各地监管政策,科学制定临床试验方案和国际化注册策略,才能高效将实验室成果转化为患者触手可及的“救命良药”。这与药审中心提出的《以临床价值为导向的抗肿瘤药物临床研发指导原则》不谋而合。
3D189是一款靶向WT1(Wilms肿瘤蛋白1)的First in class多肽肿瘤治疗疫苗,用于治疗WT1抗原过表达的恶性血液瘤和实体瘤。3D189抗原表位众多,适用于全球范围内绝大多数人类白细胞组织相容性抗原(HLA)类型,也为其之后申请更多适应症奠定了科学基础。目前3D189正在开发4个适应症,其中在多发性骨髓瘤(MM)、急性髓细胞白血病(AML)、恶性胸膜间皮瘤(MPM)等适应症方面获得了美国FDA和欧洲药品管理局(EMA)分别授予的快速通道资格或孤儿药资格。
目前,3D189单药针对AML的研究已进入III期临床试验阶段;与PD-(L)1联合用药的研究已进行到I/II期临床试验阶段;合作伙伴SELLAS(NASDAQ:SLS)针对CR2型AML研究已进入到关键III期临床试验阶段,并有望成为该靶点的全球同类首创药物。公司计划尽快CDE提交MRCT(国际多中心临床试验, III期)试验申请。
3D229是思路迪医药拥有的另一款First-in-class药物,该药物是一款靶向GAS6-AXL信号通路的抑制剂。GAS6-AXL信号通路与促进肿瘤生长及转移、肿瘤免疫逃逸与药物耐受有关,在许多恶性肿瘤如AML、肾癌、乳腺癌、肺癌、卵巢癌等都存在着高表达和活化,3D229之后的多适应症治疗应用广泛。
目前3D229已于美国及欧洲开展治疗铂耐药性卵巢癌(PROC)的III期关键性试验中进行评估;包括透明细胞肾细胞癌在内的多个适应症临床研究也已展开。思路迪医药自2020年11月从Aravive处获得该品种大中华区肿瘤领域开发及商业化的独家授权后,公司仅用6个月完成了初步技术转移。在鼓励以临床价值为导向的创新型临床试验大背景下,2021年7月5日,思路迪医药获得CDE颁发的临床试验通知书,获准加入全球MRCT III期临床试验,这是该类产品在国内首个获批的III期临床试验。3D229已在多项临床试验中展示出良好的安全性和抗肿瘤疗效。此外,试验结果显示在血清中循环游离的GAS6出现剂量相关的减少,此作为3D229的有力的药效动力学标志物。
除了合作开发和引进项目,思路迪医药也在一直进行自主开发,3D011就是一款完全自主研发、拥有全球知识产权的创新药物。据了解,公司转化医学中心全面追踪全球热门靶点,利用公司自有平台筛选潜力品种。2021年初,3D011获国家药监局临床试验批件,标志着思路迪医药已经具备研发全球知识产权创新药的原研能力。
在其他临床阶段在研品种中,3D185是一款拥有全球知识产权的创新FGFR1/2/3抑制剂,已于中美同期开展I期临床试验。3D197是新一代创新CD47抑制剂,计划将于今年内提交中国IND申请。临床前品种还包括国际领先的新一代CD3xPD-L1双特异性抗体3D057、自主研发针对“不可成药”靶点KRAS的3D062和靶向肿瘤细胞Sema4D的单抗3D060。
除了有效延长生存期外,思路迪医药也希望缓解肿瘤疼痛,提高患者长期生活质量。在其管线中还有两款毒副作用小,起效快,无成瘾性的镇痛创新药3D1001和3D1002,这两个品种有望在今年开展关键性临床试验。
02 强合作:驶入创新药开发“快车道”,为商业化构建壁垒
思路迪医药也即将迎来首个产品的商业化。2020年3月,先声药业$先声药业(02096)$ 与思路迪医药、康宁杰瑞$康宁杰瑞制药-B(09966)$ 就恩沃利单抗注射液肿瘤适应症在中国大陆的商业化达成战略合作。康宁杰瑞作为独家生产商负责生产供应,思路迪医药负责临床开发、注册和市场销售,先声药业负责在中国大陆注册上市后的独家商业推广[5]。通过与康宁杰瑞和先声药业的合作,思路迪医药在保障产品生产供应的同时,也为产品未来上市销售构建了壁垒。
除了保障恩沃利单抗注射液生产供应外,思路迪医药也开始加强其他在研产品的生产供应。今年3月,思路迪医药生产研发基地在徐州经济技术开发区的已开工建设。据思路迪医药介绍,该生产研发基地占地面积约为100亩,建成后将成为“研发生产一体化”的重要基地,并建立cGMP厂房,预计2024年竣工。为在研产品提**能保障。也为思路迪医药的全链条产业布局奠定坚实的一步。
03 练内功:经验丰富的跨国视野团队,“从零到一”的模式建立
公司由一支远见卓识、富有经验的管理团队领导,已构建涵盖从临床前研究到临床开发及商业化的整个药物开发过程的能力。董事长兼CEO龚兆龙博士除了拥有10年FDA新药评审经验外,他还曾担任昭衍新药首席技术官、莱博药业CEO、百济神州新药开发和药政事务副总裁,对创新药的研发、生产和商业化有着独到的理解。凭借着超过20年创新药行业经验,龚兆龙博士带领着思路迪医药驶入创新药开发“快车道”,核心产品恩沃利单抗注射液从全球开发模式,联合开发商业逻辑都代表了时代的最强音。

首席医学官刘东方博士在制药行业拥有逾19年全球肿瘤临床试验领导经验。曾任职于Celgene、BMS、阿斯利康制药,领导多个重磅肿瘤药物的临床研究及开发项目。
首席战略官肖申博士,在他近20年的FDA工作生涯中,负责过数百个新药开发阶段的审评工作;同时做为临床评审员和/或综合评审小组负责人负责了十余款新药的上市审批。
公司用四年的时间完成了两个阶段的开发实践,第一个阶段3D011从化合物设计到IND获批,第二个阶段恩沃利单抗从临床前推到商业化阶段。这两个典型药物的开发思路在突破创新的实践中分别达到预期目标,标志着思路迪医药的药物开发体系不断成熟,以强大的临床开发能力让创新药物早日惠及更多肿瘤患者。
龚兆龙博士此前表示,帮助肿瘤患者活得更久更好是思路迪医药的长期愿景。制药是为了人类健康,帮助患者才有价值,而在肿瘤慢病化的全球趋势下,可以为患者提供更优的肿瘤治疗和提高患者生存质量是我们的不断追求的价值!
参考资料:
1. Cancer registration in China and its role in cancer prevention and control(July 2020The Lancet Oncology 21(7):e342-e349,DOI:10.1016/S1470-2045(20)30073-5)
2.康宁杰瑞招股书
3. Overman MJ, McDermott R, Leach JL, et al. Nivolumab in patients with metastatic DNA mismatch repair deficient/microsatellite instability-high colorectal cancer (CheckMate 142): results of an open-label, multicenter, phase 2 study[J]. Lancet Oncology, 2017,18(9):1182-1191.
4. Le DT, Uram JN, Wang H, et al. PD-1 blockade in tumors with mismatch-repair deficiency[J]. N Engl J Med. 2015; 372(26): 2509-2520.
5. 先声药业《国家药监局受理KN035用于治疗MSI-H/dMMR实体瘤的生物製品上市许可申请》
免责声明:上述内容仅代表发帖人个人观点,不构成本平台的任何投资建议。



