据报道,加州圣迭戈一家生物科技公司索伦托治疗(Sorrento Therapeutics)当天发布新闻公报,声称找到了一种可以100%阻断新冠病毒侵入健康人体细胞的抗体,正向美国食品和药品管理局(FDA)申请紧急批准。消息传出,索伦托的股价当天应声飙升了158%。$Sorrento Therapeutics Inc.(SRNE)$
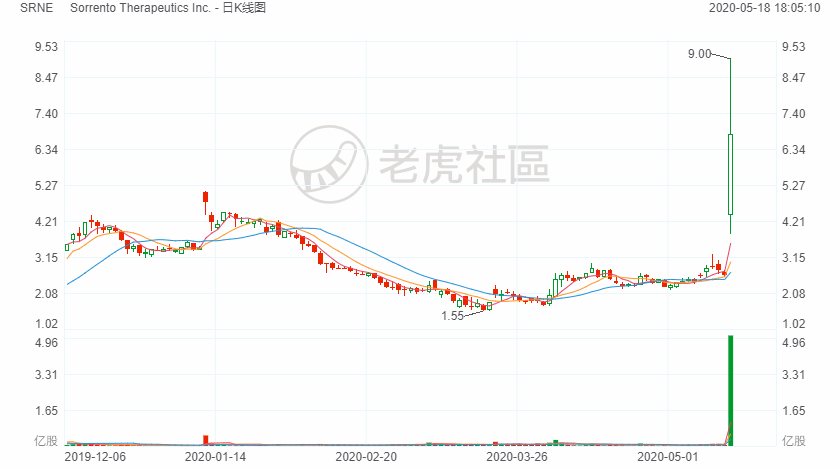
索伦托(Sorrento)公司5月16日发布了一则消息:“骄傲!新冠治疗重大突破,4天内清除病毒,100%有效!华人CEO拯救全世界.”这段谴词用语极具轰动性的消息被媒体报导后,立即让这个不出名的公司的股价最高涨幅达340%.该公司的CEO华裔季红俊在接受福克斯电视采访时说:“我们想强调的是,有一种治疗方法,可以100%有效.如果我们体内有中和抗体,就不需要保持社会距离,就可以无后顾之忧地重开复工.”
初步测试表明,索伦托公司发现的STI-1499抗体在实验室培养皿中可以100%阻断新冠病毒侵入健康人体细胞。这种抗体使得细胞表面的受体ACE2将病毒挡在细胞外,病毒因此无法存活。
据福克斯新闻报道,被病毒感染的人康复后血清中通常含有抗体,索伦托公司在过去10年中采集了数十亿份抗体样本。公司科研人员在这些样本中找到了12种可都对新冠病毒有效的抗体,正与纽约西奈山医学院合作,试图研发出多种抗体相组合的方案。
索伦托新闻公报称,公司每月可以生产20万剂这种抗体,目前正向FDA申请紧急批准。一旦该抗体获批准,将比全球各国正在研发的新冠疫苗早数月用于临床治疗。
尽管消息令人振奋,但索伦托发现的抗体尚未开展人体测试,也不知道抗体是否对人体有何副作用。
为《科学转化医学》杂志撰稿的有机化学家德里克·劳则表示,抗体生产也是一项挑战,生产流程复杂,需要严密监管防止污染。
索伦托医疗公司创立于2006年,位于美国加州圣地亚哥,全职雇员382人,是一家临床阶段生物制药公司,主要从事肿瘤学治疗和全球慢性癌症疼痛治疗的发现和开发,已在美国纳斯达克上市.CEO季红俊据称毕业于上海复旦大学生物化学专业,后在美国明尼苏达大学获得动物生理学博士学位.
中和抗体是什么?如果真实有效什么时候能用?
南京医科大学国家卫健委抗体技术重点实验室研究员冯振卿介绍,中和抗体是有抗病毒活性的抗体,可以识别病毒表面蛋白,阻断病毒与细胞表面的特异性受体结合。“为什么现在大家都在做中和抗体?首先是因为它特异性强,且高效抗病毒。”复旦大学基础医学院教授姜世勃说。
宾夕法尼亚大学医学院张洪涛教授撰文指出:这个所谓的中和抗体,事实上至今仍只是处于细胞试验的阶段.该公司宣称的4天内清除病毒,以及100%有效等等,也只是在体外细胞试验中取得的数据,所有体外试验的结果只能作为一个参考,并不能用来作为临床有效的证据,它距离真正的临床人体试验还有很远的距离, 形象的说只是万里长征第一步,目前尚无任何证据表明这款抗体对人类是安全有效的,更不意味着Sorrento找到了所谓的“终极抗体”.现在全球各国有数十个研究团队正在研究不同类型的中和抗体,至今无一款进入临床试验.
中和抗体究竟何时可用于临床?据发表在Nat Biotech的论文《治疗性单克隆抗体研发如何赶上疫期速度(Developing therapeutic monoclonal antibodies at pandemic pace)》,中和抗体开发上市的常规周期为5-8年,通过简化I期临床试验、同时进行,II期和III期临床试验等做法,最快可将时长压缩至2年左右。
对此《华尔街日报》发文对此提出质疑,标题就是“100%质疑100%冠状病毒治疗抗体”。该报导认为,这家公司抛出这种爆炸性消息,拯救的可能只是这个公司的股价。
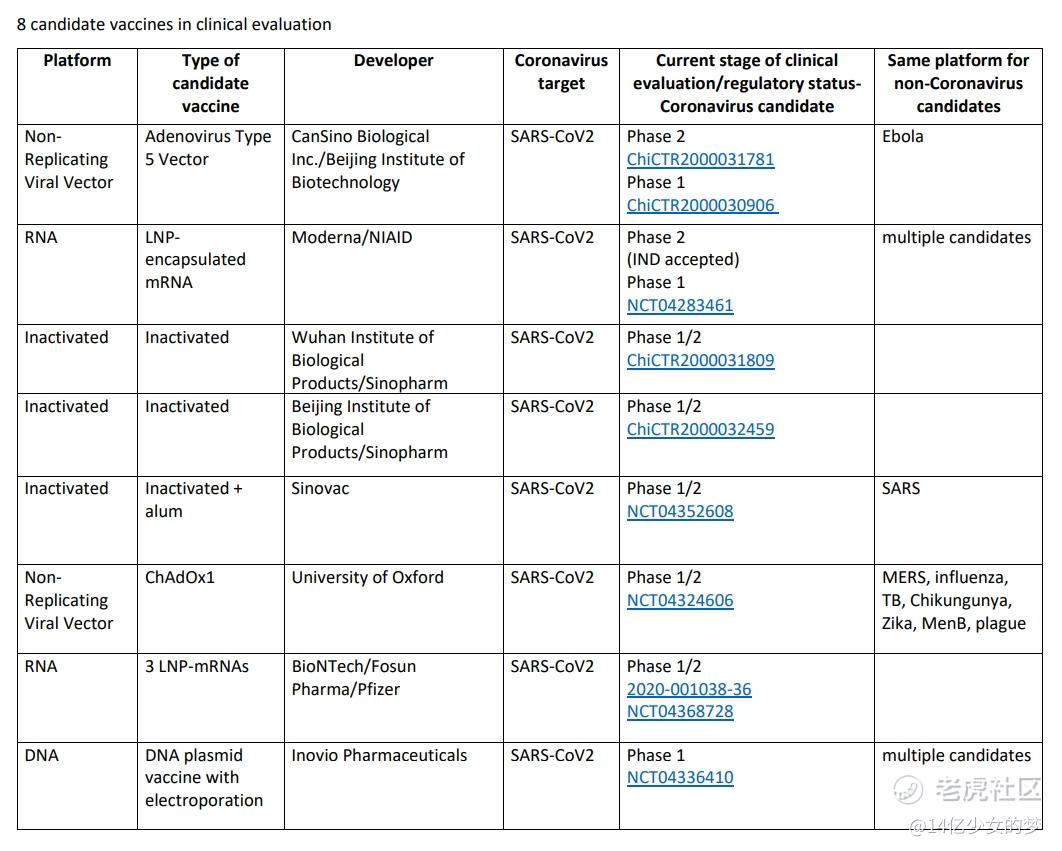
世界卫生组织(WHO)5月15日公布名单显示,全球目前共有118个研发中的新冠病毒疫苗项目,其中8种疫苗已进入临床试验阶段:中国机构占4个,美国2个,德美合作1个,英国1个。
牛津大学科学家开发的新冠病毒候选疫苗ChAdOx1 nCoV-19已经进入1期人体试验阶段,最快9月就可以应急使用。该研究的数据使该团队得以转入1期试验,4月23日开始对1110名患者进行队列试验。合并的2期和3期试验可能会在本月开始,最多将有5000人参与。阿斯利康此前已宣布与牛津大学合作,假设ChAdOx1 nCoV-19获批大规模使用,将在全球范围内开发和销售。
5月18日晨间康希诺发布公告,宣布获得加拿大卫生部关于重组新型冠状病毒疫苗(腺病毒载体)(Ad5-nCoV)临床试验申请批准。
Ad5-nCoV由康希诺生物与军事科学院军事医学研究所联合开发,采用基因工程方法,以视裂缺陷型人5型腺病毒为载体,可表达新型冠状病毒S抗原,预防新型冠状病毒感染引起的疾病 。
不过,疫苗从研发到试验,过程复杂。当前,虽然康希诺生物在时间上处于领先地位,但不到最终结果,就不能抹除其高风险。康希诺生物在此前的公告中也表示,Ad5-nCoV的安全性及有效性必须经临床研究证实,公司无法保障能最终成功开发或销售Ad5-nCoV。
$Inovio Pharmaceuticals Inc(INO)$
Inovio宣布它最近完成了第一阶段试验的注册。Inovio已在其第一阶段试验中招募了40名健康志愿者,并希望在6月下旬获得有关安全性和免疫反应的初步数据。参与者正在接受两剂疫苗,相隔四个星期。如果结果令人满意,该公司计划在获得监管机构批准后于今年夏天进行2/3期功效试验。
与传统疫苗不同,Inovio专注于优化DNA质粒的使用,而传统疫苗将弱化的病毒引入人体内以刺激免疫反应。通过计算机测序,这些小链的双链DNA被重组以在体内产生特定的免疫反应。然后,Inovio通过该公司自己的手持智能设备在皮内或肌内递送这些质粒。
Moderna的第二阶段研究将根据年龄在18至55岁和55岁以上的两组中包括600名参与者。受试者可以接受安慰剂或两种不同剂量的疫苗之一。与第一阶段一样,疫苗将间隔28天分两次接种。Moderna已完成三个剂量组的45名年龄在18至55岁之间的健康成年人的第一阶段招募,目前正在扩大研究范围,以招募另外六组老年人和老年人。1期和2期研究正在研究安全性,副作用以及疫苗诱导免疫反应的能力。该公司的目标是在今年夏天初开始进行第三阶段的研究。像Inovio一样,Moderna也不在研发传统疫苗;Moderna公司使用信使RNA(mRNA)向人体细胞发出制造预防疾病蛋白质的指令。
$BioNTech SE(BNTX)$、$辉瑞(PFE)$、$复星医药(02196)$
BioNTech 和辉瑞公司宣布,BioNTech的首批产品已进行1/2期临床试验。自2020年4月23日开始给药以来,在德国为12名研究参与者接种了候选疫苗BNT162。该试验是德国首次对**候选疫苗进行临床试验。辉瑞和BioNTech计划在获得监管机构批准后在美国启动BNT162的临床试验,预计不久后将开始。
1/2期试验的剂量递增部分将包括约200名年龄在18至55岁之间的健康受试者,目标剂量范围为1 µg至100 µg,旨在确定进一步研究的最佳剂量以及评估疫苗的安全性和免疫原性。该研究还将评估初次注射后三种候选疫苗的重复接种的效果,这三种候选疫苗均含有尿苷含mRNA(uRNA)或核苷修饰的mRNA(modRNA)。单次接种疫苗后,将评估包含自我扩增mRNA(saRNA)的第四个候选疫苗。研究的第二部分将包括患有严重**疾病的较高风险的受试者。
BioNTech和辉瑞公司正在共同开发BNT162。在临床开发阶段,BioNTech将通过其在欧洲具有GMP认证的mRNA生产设施为合作伙伴提供疫苗的临床供应。BioNTech正在与复星医药合作在中国开发BNT162,这两家公司希望在该国进行试验。
精彩评论