大家好,今天分享的是$辉瑞(PFE)$ 公司的2021Q3季度财报,有关辉瑞是什么一家公司以及疫苗和口服抗疫的内容可以参考:2021Q2财报 | 辉瑞财报分析 疫苗收入即将超过主营,这篇文章中我用了大量篇幅阐述了关于疫苗和抗疫的一些内容,其中包含mRNA和灭活疫苗的区别。
相隔一个季度,更多的人接种了疫苗,无论是mRNA还是灭活疫苗,也请大家在外注意安全,注意防疫,千万不要掉以轻心。在上一篇财报中,提到了疫情也很难短期结束,现在过了一个季度,疫情仍然难以完全结束,清零更是难上加难。在面对冠形病毒的同时,我们也在面对可能到来的各种危机。
这个季度的辉瑞财报,就不在科普专业知识和上一份辉瑞财报提到过的内容了,Q3财报依旧延续了辉瑞公司晦涩难懂大幅专业名词和生物医药名词,有些词汇甚至字典上都查不到,我尽量用直白的语言给大家解读财报内容。有关公司组成情况药物名称等也可以参考上一份财报。
那我们直接奔入主题,先来回顾下Q2情况,再来看看辉瑞这个季度的情况如何,以及对未来股价的估值。
2021Q2财报估值回顾
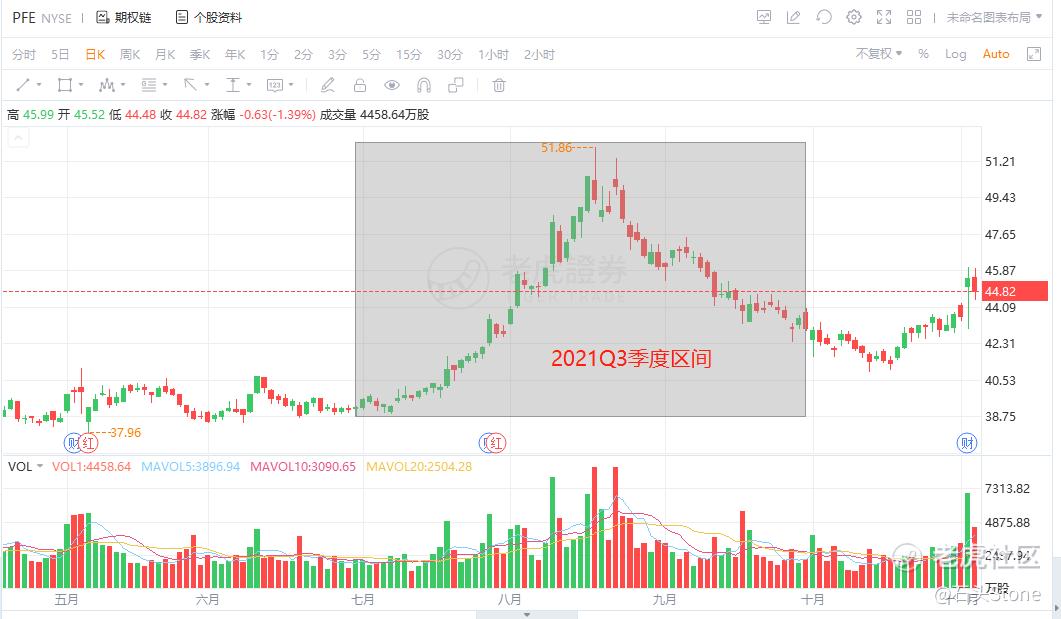
截止北京时间2021年7月29日收盘,辉瑞的股价已经突破了43美金,收在了43.45美金,无限接近历史高点。就财报中显示的内容来看,BNT162b2疫苗注射在2021年理论上无法完全截止,融入BNT162b2的营收,以及未来大流行大概率会跟人类共存的情况,推演辉瑞的估值目前正处于合理估值区间,在未来一段时间内大概率都会处于高位40以上,并且极大的可能性突破历史新高。
- 目标价格:46-50美金(可能还会更高,这取决大流行的发展情况)
- 支撑位:38-40美金
估值价位成功,Q3期间果然突破新高,然后出现股价回落。依靠Q2财报,我短期购买辉瑞公司股份并在高位清仓,详细可以看空间站贴:
高位清仓辉瑞:
2021Q3财报亮点
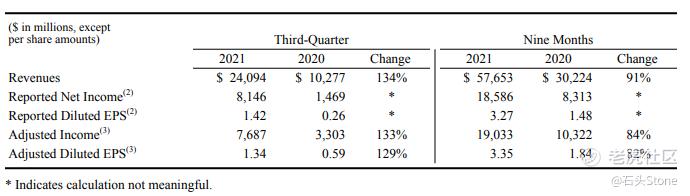
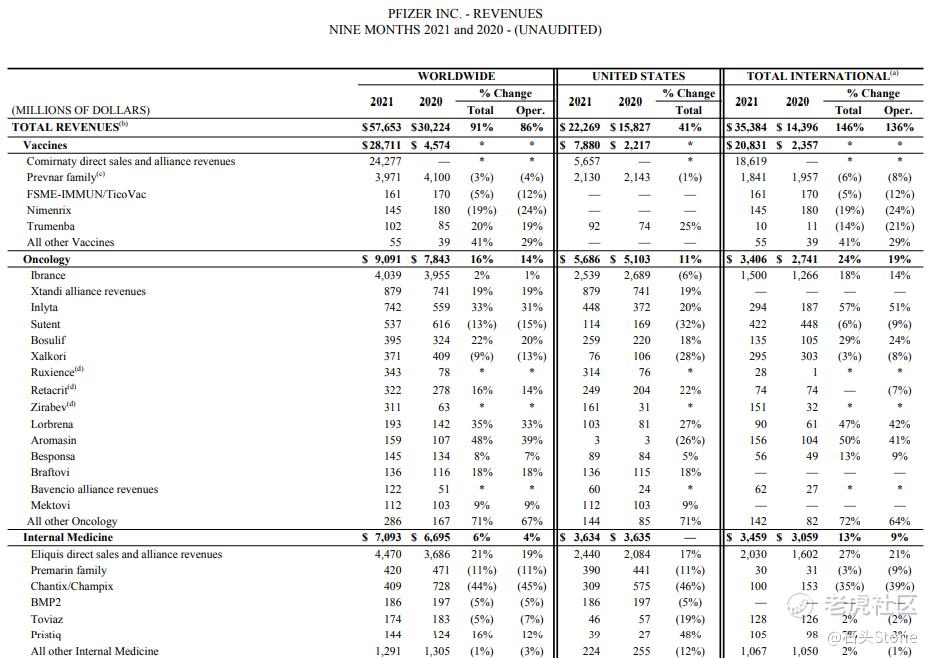
- 2021Q3营收,包含疫苗部分,至241亿美元,增长130%
- 2021Q3营收,刨除疫苗部分,至111亿美元,增长7%
- 2021Q3稀释每股收益为1.42美元,调整后稀释每股收益为1.34美元
- 提高2021年全年的指引,至全年营收达到810亿 - 820亿之间
- 调整2021年稀释每股收益至 4.13美元 - 4.18美元
- 预计2021年疫苗部分收入可以达到360亿美元,并且预计在2021财年中提供23亿疫苗
- 将不包括疫苗有关部分的经调整稀释每股盈余指引,上调至2.60至2.65美元
在2020年Q4季度完成Upjohn业务分拆后,辉瑞将作为一家专注于在全球范围内发现、开发、制造、营销、销售和分销生物制药产品的创新生物制药公司运营。
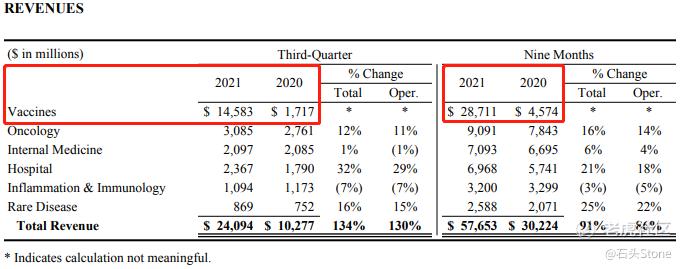
通过公布的Q3财报中可以看出,疫苗业务在2021年出现了爆发式增长,随着接种人群的增多,辉瑞疫苗预计在Q4季度仍然可以得到大量的收入,目前我们要考虑的问题是对于$默沙东(MRK)$ 这家公司,早先其公布了口服**药研发成功,等待批准,那么我们再继续读这份辉瑞的财报,看看在Q2季度辉瑞公布的口服**药,在这个季度有没有什么进展,能否与其竞争对手展开抗衡呢。
2021年财务指引
辉瑞提高了2021年公司总收入指导和调整后稀释每股收益。这反映了抗疫产品及其他业务对2021年业绩贡献的最新展望的净影响。调整全年预期后研发支出的指导范围增加,主要是为了反映对COVID-19和基于mRNA的项目的预期增量支出。财务指引的其他各部分的范围在之前的范围内收紧,主要是为了反映时间的推移和到目前为止的实际表现。目前的2021年财务指导如下。
- 营收:810 - 820亿美元(先前为78亿至800亿美元)
- 调整后的销售成本占收入的百分比:39.1% - 39.6% (先前为 39.0% to 40.0%)
- 调整研发费用:104 - 109亿美元(先前为100 - 105亿美元)
收入指导区间的中位数较2020年增长94%;调整后稀释每股收益的最新指导区间的中位数反映出比2020年实际结果增加了84%;调整后稀释每股收益的财务指引,使用约57亿股加权平均流通股计算,并继续假设2021年没有股票回购。
对于2021年辉瑞抗疫产品预估
抗疫产品收入预测包含在辉瑞的2021财年财务指导中,包括预计在2021财年交付的约23亿剂疫苗。预测基于截至12月底的美国订单模式和截至11月底的世界其他地区订单模式。
- 辉瑞和BioNTech预计到2021年12月底共生产30亿剂疫苗。
- 预计将有助于2021年收入的剂量数量与预计到年底制造的剂量数量之间的差异与12月预计的国际交付量有关
- 根据财政日历,部分抗疫产品营收将录入在2022年
调整后抗疫产品的IBT保证金指导:包含产品预期收入、营销和分销成本,专利使用费,与BioNTech分享50%的毛利润,以及与正在进行的研发相关的费用,由于自7月中旬以来辉瑞已经签署了额外的供应协议,纳入上述考量后,更新后的预估如下:
- 预计2021年全年,公司的总营收对比2020年,可以提高20%以上
对于2021年辉瑞扣除抗疫产品的预估
排除掉辉瑞公司抗疫产品后,营收指导区间将会有6%左右的增长,虽然符合辉瑞早些声明的在2025年前,每年至少保证6%的增长目标,但是我们通过财报也可以看出,在2021年期间,辉瑞的主要增长还是需要依靠抗疫产品的支持,财报的漂亮数据也是需要抗疫产品的支持,一旦剥离掉抗疫产品,辉瑞公司的增长潜力虽然稳定,但是空间也变小了。因此就目前的发展来看,当疫情结束的时候,也是辉瑞公司股价回撤的时间点。
资产配置
- 在2021年前9个月,辉瑞支付了65亿美元的现金股息,即每股1.17美元的普通股,每股股息较去年同期增加了3%
- 到2021年为止,还没有完成股票回购。截至2021年11月2日,辉瑞剩余的股票回购授权金额为53亿美元。目前的2021年财务指引没有反映2021年的任何股票回购
- 2021年第三季度稀释加权平均流通股的稀释每股收益为57.25亿股,增加9200万股,主要是由于为员工薪酬计划发行的股票。
季度财务亮点(2021Q3 vs. 2020Q3)
2021年第三季度的总收入为241亿美元,同比增长138亿美元,增幅为134%;运营增长134亿美元,增幅为130%,同时受到外汇交易4.21亿美元的有利影响,增幅为4%;2021年第三季度运营增长主要由以下因素推动:
- 抗疫产品贡献了130亿美元的直接销售和联盟收入;
- Eliquis全球业务增长19%,主要受非瓣膜性心房颤动应用持续增加和口服抗凝剂市场份额增加的推动
- Vyndaqel/Vyndamax的运营价格上涨42%
- Inlyta全球业务增长30%,主要反映了美国和欧洲开发的某些免疫检查点抑制剂与Inlyta联合用于晚期肾细胞癌一线治疗的持续应用
- Xtandi在美国的销量增长了16%,主要是由于转移性和非转移性去势抗前列腺癌适应症以及转移性去势敏感前列腺癌适应症的强劲需求
- 由于COVID-19导致的诊断和治疗延误在多个国际市场显示出复苏迹象,需求加快,美国以外的Ibrance业务增长9%
- 全球医院产品,运营增长29%至24亿美元,主要受辉瑞CentreOne的推动,辉瑞的合同制造业务,反映了某些comirnaty相关的生产活动,代表BioNTech和Viatris的传统Upjohn产品的制造。以及来自国际市场的增长,主要是受抗感染产品组合的驱动
- 生物仿制药:运营规模增长34%,至5.75亿美元,主要是受近期肿瘤单克隆抗体生物仿制药Ruxience(利妥昔单抗)、Zirabev(贝伐单抗)和曲妥珠单抗(曲妥珠单抗)的上市以及Retacrit (epoetin)在美国的持续增长推动
注意:以下部分有所减少
- Chantix在全球范围内,操作上下降了97%,召回在多个市场和全球暂停发货N-nitroso-varenicline以上Chantix;由于存在全球监管机构设定的摄入量,因此公司决议召回产品。
- Prevnar系列(Prevnar/Prevenar 13 & 20)由于美国卫生当局持续优先开展COVID-19初级和强化疫苗接种,且流感季节较前一年开始较晚,因此下降了36%
- Sutent在全球的运营下降了31%,因需求量下降引起
- Xeljanz在美国市场下降了13%
- Enbrel国际业务下降12%
财务收益重点
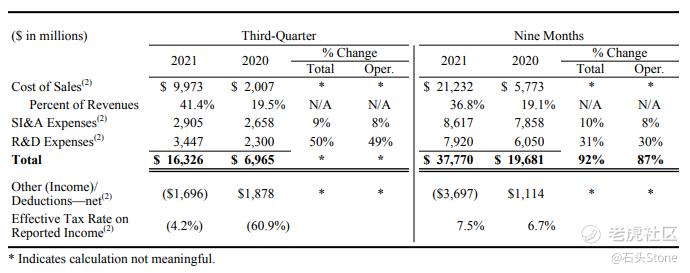
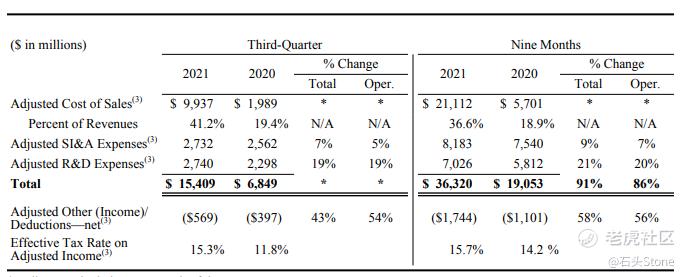
销售成本占收入的百分比较上年同期增加21.9%,主要原因:
- 与抗疫销售相关增加21%,其中包括与BioNTech的分成和适用的版税费用的费用
- 产品结构的不利变化,反映了包括辉瑞CentreOne业务收入在内的低利润产品的销售增加和Chantix的销售减少,部分抵消了联盟收入增加的有利影响。
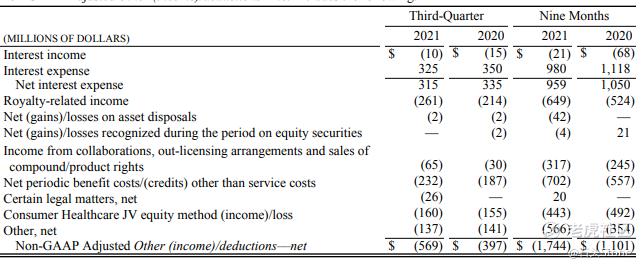
与上年同期相比,2021年第三季度运营费用增长了8%,与上年同期相比,其他成本更接近于大流行前水平。2021Q3研发费用同比增长49%,以开发和商业化ARV-471,并增加在多个治疗领域的投资。包括与新冠病毒抗病毒项目开发和风险制造相关的额外支出。辉瑞在2021Q3记录了17亿美元的其他净收入,而在2020Q3,其他扣除净额为19亿美元。
产品开发情况
- 阿比瑞拉达(adalimumab-afzb)
2021年9月,辉瑞公司从REFLECTIONS B538-12研究中获得了积极的基线结果,该研究评估了阿比瑞拉达及其参考产品Humira之间的多种治疗切换,在患有中度至重度类风湿关节炎的成年患者中,这两种药物均给予甲氨蝶呤。
该研究通过证明在两种药物治疗之间多次切换的患者的药代动力学等效性达到了其主要终点。两组的安全性和免疫原性相似。根据辉瑞与原药公司的协议条款,该计划最早于2023年7月1日在美国推出无柠檬酸的Abrilada。
- Chantix (varenicline)
2021年9月,辉瑞在美国自愿召回所有批次的Chantix,原因是一种亚硝胺,n -亚硝基varenicline达到或超过FDA临时可接受摄入量限制。亚硝胺在水和食物中很常见,每个人都暴露在一定程度的亚硝胺中。如果人们长时间接触这些杂质超过可接受的水平,就会增加患癌症的风险。比如戒烟在理论上可以比吸烟者更加有效的抵抗因为亚硝胺引起的潜在癌症风险。
- Cibinqo (abrocitinib)
2021年8月,辉瑞宣布JADE DARE (B7451050),这是一项为期26周、随机、双盲、双模拟、主动对照、多中心的3期研究,评估了阿布西替尼200 mg与dupilumab 300 mg的试验,用于中度至重度特应性皮炎。
- Comirnaty (BNT162b2, COVID-19 Vaccine, mRNA)(抗疫产品)
2021年9月,辉瑞和BioNTech宣布BNT162b2 2/3阶段试验结果,实验显示目前抗疫产品可以良好和安全的应用在5 -11 岁的儿童身上:采用两种剂量方案,每次10µg,并间隔21天。受试者接种10µg剂量的疫苗后,身体反应与之前辉瑞-生物技术公司(Pfizer-BioNTech)在16-25岁人群中接种30µg剂量疫苗的反应结果类似。根据安全性、耐受性和免疫原性,5 - 11岁儿童选择10µg剂量作为首选剂量。
2021年8月,辉瑞和BioNTech宣布启动向FDA提交生物制品补充许可申请(sBLA),以批准疫苗增强剂(第三剂),以预防16岁及以上人群感染COVID-19。
2021年9月,辉瑞和BioNTech宣布,FDA授权65岁及以上、18至64岁严重COVID-19高风险人群紧急使用疫苗增强剂。以及经常在机构或职业暴露于SARS-CoV-2的18至64岁的个人。强化剂(第三针)应在完全接种疫苗后至少6个月进行,配方和剂量强度与初级系列相同。
此外,在2021年10月,FDA批准紧急使用一剂增强剂给已接种其他品牌疫苗的个体使用,间隔时间同样是至少在完全接种疫苗后的6个月。
2021年10月,欧盟对辉瑞抗疫产品进行了更新,Comirnaty作为30µg增强剂,适用于18岁及以上的个人,在第二次注射后至少6个月。
2021年10月,辉瑞和biotech宣布,FDA已批准BNT162b2用于5至11岁儿童的紧急使用。对于这一情况,疫苗将分两次注射,每次10µg,间隔21天。
- 商务合作
2021年8月,辉瑞和BioNTech宣布与巴西生物制药公司Eurofarma laboratonia rios SA签署意向书,生产Comirnaty并在拉丁美洲独家销售。根据协议,Eurofarma将从美国的工厂获得相关药品,疫苗生产将于2022年开始,预计每年生产超过1亿剂。
2021年9月,辉瑞和BioNTech宣布计划扩大与美国政府的协议,以非营利性价格提供额外的5亿剂疫苗,捐赠给低收入和中低收入国家和支持它们的组织。这项扩大后的协议使美国政府向这些国家捐赠的疫苗总数达到10亿剂。最初剂量的交付于2021年8月开始,预计到2022年9月底将交付总共10亿剂剂量。
2021年10月,辉瑞和BioNTech宣布,美国政府行使了根据现有美国供应协议的最终购买选择权,额外购买5000万剂疫苗。这些额外的剂量是为了支持美国儿科疫苗接种的准备工作,包括在5岁以下儿童获得监管机构授权时获得疫苗。这使目前根据该协议获得的剂量总数达到6亿剂,涵盖成人、青少年和儿童的剂量。这些公司预计将在2022年4月30日之前交付所有这些剂量。
- PF-07321332 (口服抗疫药)
PF-07321332 是一种研究性 SARS-CoV-2-3CL 蛋白酶抑制剂抗病毒疗法,专门设计用于口服药,以便在出现感染迹象或第一次意识到暴露时就可以开处方,而无需患者住院治疗。
蛋白酶抑制剂,如 PF-07321332,旨在阻断冠状病毒复制所需的主要蛋白酶的活性。预计与低剂量利托那韦合用有助于减缓 PF-07321332 的代谢或分解,使其在体内以更高的浓度保持更长时间的活性,以帮助对抗病毒。
2021 年 3 月,辉瑞将 PF-07321332 推进到健康成人的 1 期研究,以评估研究化合物的安全性、耐受性和药代动力学,观察其疗效和安全性,与利托那韦组合,确诊为 SARS-CoV-2 感染且极有可能发展为严重疾病的参与者。
2021年8月,辉瑞给EPIC-SR(对标准风险患者COVID-19的蛋白酶抑制评估)的第一位参与者服用药物。EPIC-SR是一项关键的2/3期临床试验,旨在评估PF-07321332/利托那韦在非住院患者中的安全性和有效性。确诊为SARS-CoV-2感染且病情发展为可能导致住院或死亡的严重疾病的风险没有增加的有症状的成年参与者。这项随机、双盲试验将纳入约1140名参与者,他们将连续5天每12小时口服抗疫药物。
2021年9月,辉瑞宣布启动关键的2/3期EPIC-PEP(暴露后预防中的COVID-19蛋白酶抑制评估)研究,以评估PF-07321332与低剂量利托那韦共用药预防COVID-19感染。这项随机、双盲、安慰剂对照试验将纳入多达2660名18岁以上的健康人群,他们与确诊的SARS-CoV-2感染患者生活在同一家庭。
关于口服抗疫药的内容暂时就这么多,翻遍了辉瑞公司的公开文件,以及测试情况的来看,个人还是持乐观态度,并且随着进度的公开,口服药的成分和方式也逐渐显露出现,根据有限的披露文件推测,在Q4季度我们有极大的可能性得到新的测试结果以及情况。
- 迄今为止进行的体外研究表明,临床候选物 PF-07321332 是一种强效蛋白酶抑制剂,对 SARS-CoV-2 具有强效抗病毒活性
PF-07321332 是第一个在临床研究中进行评估的口服冠状病毒特异性研究蛋白酶抑制剂,目前没有批准用于 COVID-19 暴露后或先发制人治疗的口服疗法(默沙东说自己是第一个成功口服药,但是截至目前,并没有太多公开消息,根据查询文献,目前来看,辉瑞仍保持首列)
随着 COVID-19 在世界各地的持续影响,我们认为应对该病毒将需要对感染或接触过该病毒的人进行有效治疗,从而补充疫苗在帮助平息感染方面的影响。
如果成功,我们相信这种疗法可以帮助及早阻止病毒,在它有机会广泛复制之前,有可能预防那些接触过病毒的人出现症状并抑制其他人感染的发生。
——医学博士 Mikael Dolsten,博士,辉瑞首席科学官兼全球研究、开发和医疗总裁。
除了这项研究之外,全球 EPIC 计划还包括多项正在进行的临床试验,包括一项于 2021 年 7 月开始的针对具有严重疾病(包括住院或死亡)高风险的 SARS-CoV-2 感染患者的临床试验,以及另一项于 2021 年 8 月开始的标准风险(即没有严重疾病风险因素)的感染患者
根据公开信息显示,测试人群均是确诊人群,并且自愿参加测试。随着默沙东公开的口服抗疫药后,相信辉瑞也会加快脚步,尽快公布测试数据。
另外按照辉瑞公司命名药物的方式来看,该款药大概率是由辉瑞公司开发,不涉及到未来向疫苗那种分成方式,如果成功,将会对公司来说是非常大的利好。
公司发展
2021年8月,辉瑞和Trillium Therapeutics Inc. (Trillium)宣布双方达成最终协议,根据该协议,辉瑞将收购Trillium,这是一家开发癌症创新疗法的临床阶段免疫肿瘤公司。根据协议条款,辉瑞将以每股18.50美元的价格,或约22.6亿美元的总收购价格,收购Trillium所有未被辉瑞持有的已发行股票。该收购计划预计将在2021年第四季度或2022年上半年完成,但需符合惯例的交易条件。
2021年8月,辉瑞宣布Aamir Malik加入公司,担任执行副总裁兼首席业务创新官,向董事长兼首席执行官Albert Bourla汇报。Malik先生接替John Young,执行副总裁兼首席商务官,John Young在辉瑞34年的职业生涯结束后,宣布将于2022年初退休。
2021年11月,辉瑞与总部位于纽约的医疗投资公司Altaris Capital Partners, LLC (Altaris)达成协议,由Altaris收购Meridian医疗技术公司(Meridian)。Meridian于2011年被辉瑞收购,作为King Pharmaceuticals收购的一部分,从那时起一直保持相对的经营自主权。
总结与估值
辉瑞公司的经营并没有太大问题,但是默沙东早于辉瑞公布了口服抗疫药的消息,让默沙东股价短期内得到拉升,并且进展也快于辉瑞,在辉瑞公开的消息中,我们可以看到辉瑞开发的抗疫口服药,仍在测试中,按照进度推测,Q4季度将会有新的消息公布,目前进行的两期测试,均没有公开其成功率。
随着时间的推移,疫情并没有因为时间而完全结束,反而变种又在蔓延,这不得不让疫苗也出现了第三针,之后会不会有有第四针或者更多,以及口服抗疫药是否有效,都是需要关注的事情。同时,主流大国目前也持不在继续封锁国门的意思,通勤也正在正常,经济虽然得到了恢复,但是防疫、抗疫还是任重而道远。
Q4季度辉瑞公司依旧没有回购计划,但是公司财务中有一部分资金是用来回购股票的,并且Q4季度面临Taper缩表开始,以及各种经济数据将会在未来一段时间陆续公布,综合各种考量后,计算估值:
- 上调Q4目标价格:48-55美金
- 支撑位:40美金
参考文献
- 2021Q2财报 | 辉瑞财报分析 疫苗收入即将超过主营
- PFIZER REPORTS THIRD-QUARTER 2021 RESULTS
- Pfizer and BioNTech Receive First U.S. FDA Emergency Use Authorization of a COVID-19 Vaccine in Children Ages 5 Through 11 Years
- Pfizer and BioNTech to Provide U.S. Government an Additional 50 Million Pediatric Doses of COVID-19 Vaccine to Support Further Preparedness for Future Needs
- FDA Advisory Committee Votes in Favor of Granting Emergency Use Authorization for the Pfizer-BioNTech COVID-19 Vaccine in Children 5 to <12 Years
- Pfizer and BioNTech Announce Phase 3 Trial Data Showing High Efficacy of a Booster Dose of Their COVID-19 Vaccine
- Pfizer Starts Global Phase 2/3 EPIC-PEP Study of Novel COVID-19 Oral Antiviral Candidate for Post-Exposure Prophylaxis in Adults
- Pfizer Initiates Phase 1 Study of Novel Oral Antiviral Therapeutic Agent Against SARS-CoV-2
欢迎大家订阅我的空间站“石头的投资笔记”,这里我会分享持仓股票、投资策略,以及重点关注公司,也会结合市场分享交易策略、技术指标、公司估值以及调研报告。祝大家投资愉快!






精彩评论