近日,和黄医药将呋喹替尼中国内地、香港、澳门以外的商业化权益授予武田,获得了4亿美元的首付款和总额高达7.3亿美元的潜在里程碑付款。这项License out交易,也刷新了中国创新小分子药物对外授权首付款的最高记录。
在大分子创新药横行市场的当下,这一交易也证明了小分子药物依旧拥有旺盛的竞争力与市场生命力。
继和黄之后,谁会是下一个小分子重磅授权交易的缔造者?
一家国内小分子创新药Biotech近日连续迎来两个好消息。
1月18日,亚盛医药-B按每股24.45港元配售2250万股份,获得5.5亿港元,为现有核心产品临床开发提供了夯实的资金储备。
亚盛医药的奥雷巴替尼首次谈判成功进入医保,谈判前后年费用分别为18.75万(赠药后)、17.44万,以较小的降幅顺利完成了医保的准入。
目前,市场未充分消化这两个利好。首先2022年12月底以来港股生物科技公司迎来了非常重要的估值探底回升修复窗口期,亚盛医药作为现金储备排名中游的Biotech公司(2022年6月底16.99亿人民币现金等价物),迅速完成了一轮现金流补血;其次,奥雷巴替尼以实际微弱的降价进入医保,在促进产品未来两年放量的同时,对潜在的销售峰值影响较小。
虽然在市值层面上亚盛医药的潜在价值未被充分释放,但两个核心产品管线已经展现出很强的潜力和向市场释放出一定好的预期。
01 奥雷巴替尼国内放量在即,BD箭在弦上
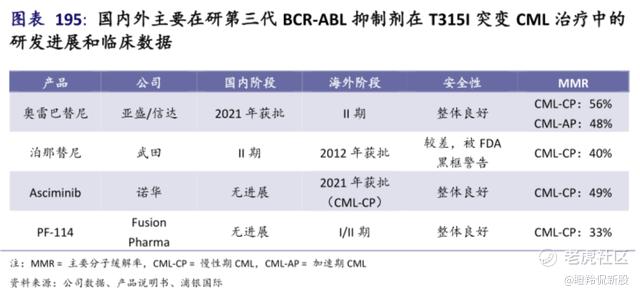
奥雷巴替尼,是亚盛医药目前唯一一个实现商业化的核心产品,也是中国首个且唯一获批上市的第三代BCR-ABL抑制剂。
2021年11月获批上市到2022年6月底,累计含税销售额为人民币9593万元,有机构预测全年销售额有望达到2亿元。
近期,奥雷巴替有望迎来新适应症获批的催化。
2022年7月,CDE受理了奥雷巴替尼的新适应症上市申请,用于治疗一代和二代酪氨酸激酶抑制剂(TKIs)耐药和/或不耐受的慢性髓细胞白血病(CML)慢性期(CP)患者。
奥雷巴替尼已上市的第一个适应症是,任何TKIs耐药后伴有T315I突变的CML患者,而T315I在耐药CML中的发生率高达25%。也就是说,该适应症获批后奥雷巴替尼覆盖的CML患者群体将扩大3-4倍。
值得注意的是,该项新适应症的申报上市已纳入优先审评,按照过往新药新适应症上市经验,推算从申报到获批大概需要半年时间,有可能在近期获批。
另外,奥雷巴替尼在刚刚结束的医保谈判中以较低的降价幅度被纳入,意味着新的适应症将在2023年末医保谈判中采用简易续约的形式纳入,将实现平价或较低降价水平来惠及更多患者,从而增厚销售业绩。
海外临床同样迎来好消息,在前段时间时间的ASH大会上亚盛医药拿到了4个口头报告,其中奥雷巴替尼就获得了3个(连续5年获得ASH口头报告,创造了历史)。
需要正视的是,奥雷巴替尼在美国属于“有大量未满足临床需求”的急需药品。
T315I基因突变CML患者长时间以来只有普纳替尼一种药物用于治疗,但普纳替尼安全性有较大的瑕疵,有较高概率引发患者血栓和血管重度狭窄,尽管FDA曾一度停止其销售,但最终未让其彻底退市。而在奥雷巴替尼最新公布的一项ASH摘要中显示:奥雷巴替尼在接受过普纳替尼治疗的患者中也有显著的疗效(12例中有10例获得CCyR),且对普纳替尼不耐受或者耐药后的患者使用不会增加安全性风险。
目前,奥雷巴替尼正在美国开展桥接试验,预计将在今年披露相关进展。
尽管海外临床正在进行中,但我们可以在今年就看到奥雷巴替尼获得不菲的海外销售收入。
2022年8月,亚盛医药与Tanner Pharma启动制定患者药物启动计划(NPP),计划覆盖100多个国家和地区。简而言之,该项计划将帮助全球具有支付能力但无药可用的患者能够最快的用到国际上已经获批且有定价的创新治疗药物,预计2023年将为奥雷巴替尼销售贡献一定力量。
对于奥雷巴替尼的销售峰值预判,市场一直存在争议。大多数不看好奥雷巴替尼的观点主要以第三代普纳替尼的在2021年销售额在2-3亿美元标准来论述(2021年CML市规模约60亿美元,有机构预计其2025年销售峰值将达6.05亿美元),但实际上FDA给予的黑框警示&严格限制其临床使用带来了一定影响。奥雷巴替尼在CML、ALL适应症上作为普纳替尼的更好及耐药后的唯一选择,很有可能在全球冲击10亿美元的销售峰值。
同时,短期来看公司给予的2023年国内冲击5亿人民币销售额,也同样值得期待。
02 APG-2575有望比肩V药,潜在的Big Deal
不仅奥雷巴替尼,市场对于亚盛医药的Bcl-2抑制剂APG-2575拥有更高的预期。
Bcl-2基因是一种重要的细胞凋亡抑制因子,在抑制细胞的程序性死亡起到重要作用。而Bcl-2抑制剂不仅可以单药使用杀伤癌细胞使细胞凋亡的程序死亡恢复,同时还可以联用其他药物增加癌细胞对药物敏感性。
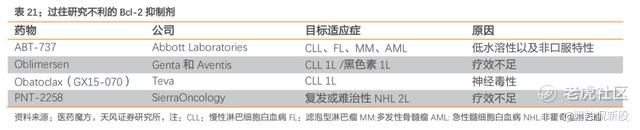
所以,Bcl-2抑制剂又被市场视为继BTK后下一个血液瘤领域的重磅药物,引发多家药企药企投入大量精力,但大多早期研发分子因为疗效不足、安全性问题而失败(这是一个很难的靶点)。
目前,全球只有一款Bcl-2抑制剂在市(2016年首次获批),是艾伯维和罗氏共同开发的维奈托克(又称V药)。V药上市以来,商业化呈现高歌猛进的趋势,2021年销售额达到18.2美元。
亚盛医药的APG-2575,是全球第二个、国内第一个看到明确疗效并且进入注册性临床的Bcl-2抑制剂。
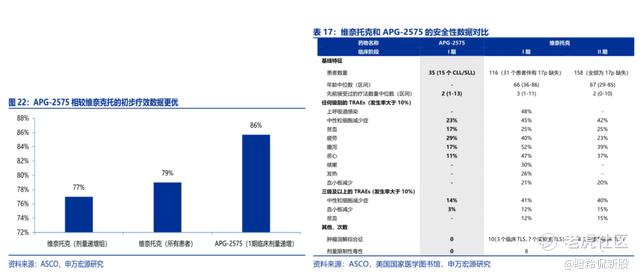
在ASH会议中亚盛医药公布了APG-2575二期初步数据:APG-2575单药治疗r/r CLL/SLL客观缓解率(ORR)为67%,联合阿卡替尼治疗r/r CLL/SLL的ORR达98%(一线患者ORR高达100%)。
在APG-2575单药治疗数据表现层面,虽然二期初步的ORR低于一期的80%+,但考虑到临床试验入组病人基线(一半患者四线以上病人,V药在类似病人中ORR也在50-60%),这已经是非常令人满意的数据了。另外,APG-2575在安全性的数据上更为突出,V药为了避免肿瘤溶解综合症TLS等副作用,要5周才能给患者提升到指定剂量,而APG-2575只需要5天(TLS基本没有发生);并且,APG-2575的安全性展现出了极高的安全性。
更令人惊艳的是APG-2575与阿卡替尼联用的效果,远高于V药+伊布替尼的89%。再细化来看,阿卡替尼于伊布替尼进行了非劣性的头对头,排除掉这个影响因子,相信是APG-2575在该联用组合中起到了决定性的作用。
总结而言,APG-2575未来存在三个大的潜在预期兑现,第一个是国内CDE支持二期注册性临床作为r/r CLL/SLL的上市申请,第二是海外大样本量的联用BTK临床数据验证,第三则是海外Lisence out。
目前,正在进行的APG2575CC201(临床代号)是一项在r/r CLL/SLL患者中进行的注册II期临床研究,该研究的主要终点指标为总缓解率(ORR)。基于APG-2575目前已获得的安全性、有效性数据,CDE已同意该项研究结果将支持未来适应症R/R CLL/SLL的上市申请,APG-2575有望在2023年底或2024年初在国内报NDA。
据艾伯维对于V药的预测,2025年其销售峰值可能将达到50亿美元,APG-2575作为后发的me-better甚至best in class,有望分得其中巨大的市场。
从当前APG-2575所展现出的数据和潜力来看,获得一个大的海外授权几乎是大概率事件,要看亚盛医药的管理层如何去考量BD利益最大化。
03 亚盛医药的茅:“孤儿药”大王、卖好货的传统
亚盛医药曾被市场的投资者赋予“孤儿药大王”的美称。
截至目前,亚盛医药共有4个在研新药获得16项FDA和1项欧盟孤儿药资格认定,2项FDA快速通道资格以及2项FDA儿童罕见病资格认证。
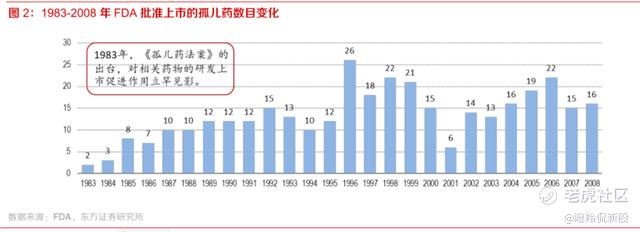
获得如此多的“孤儿药”资格一方面侧面应证了公司的研发实力,另一方面则有很多实实在在的“好处”:1)孤儿药法案允许孤儿药研究和临床设计向FDA寻求特别协助,这意味着在海外临床设计上少走更多弯路,在药物有效&安全性过硬情况下,为后面获批扫清障碍;2)费用的减免(比如免除NDA申请费、临床研究费用税收减免等);3)上市独占期,有孤儿药认证的获批新药将拥有7年的市场独占权,该保护不受专利权影响;
另外,两位管理层杨大俊和王少萌拥有“将好货卖高价”的优良传统。
亚盛医药的管理层杨大俊、王少萌原来均为美国大学的教授,两人有超过20年的合作经验,当年赛诺菲和瑞士德彪收购了两人研发的细胞凋亡化合物,2010年赛诺菲收购的MDM2-p53靶点化合物整体费用近4亿美元,创下了华尔街当时最大的一笔医药交易。瑞士德彪收购的IAP拮抗剂,其在2021年3月以近9亿欧元授权给了默克。
2021年7月,亚盛医药将奥雷巴替尼在中国的商业化权益授予信达生物,获得0.3亿美元首付款+最高不超过1.15亿美元的里程碑付款。同时,亚盛医药获得信达生物5000万美元投资,两年内有权再投资5000万美元。
尽管历史成就并不能作为推测未来交易的逻辑依据,但就目前亚盛所有拥有的已商业化、临近商业化品种审视,有理由相信未来公司必定会有大的License out。
结语:除了奥雷巴替尼、2575外,亚盛医药还有APG-1252(Bcl-2/Bcl-xL双靶点抑制剂)、APG-115(首个进入临床阶段的MDM2-p53抑制剂,3个孤儿药认证)等处于临床阶段的潜力管线,同时还拥有蛋白降解(Protac)技术管线布局,保证了后续的产品接力。
就目前亚盛医药来看,可以明确判断市场仍未充分意识到“配售+医保谈判”对于公司的正面影响,同时基于对公司2023年潜在里程碑和商业化的判断,公司近期有潜力冲击90-100亿港元的市值。$和黄医药(00013)$ $亚盛医药-B(06855)$ $百济神州(688235)$


精彩评论