继ADC之后,PD-(L)1/VEGF双抗、CD3/“X”双抗、B细胞耗竭策略双抗等领域BD交易火热。
双抗为什么会一下子火热起来?PD-(L)1/VEGF双抗是基于康方生物AK112在国内和K药头对头取得的成功和其背后可蚕食K药迭代大适应症市场,而CD3/“X”双抗则是基于其广阔的适应症拓展潜力,除了血液瘤之外,还有自免、实体瘤等巨大的待扩展市场。
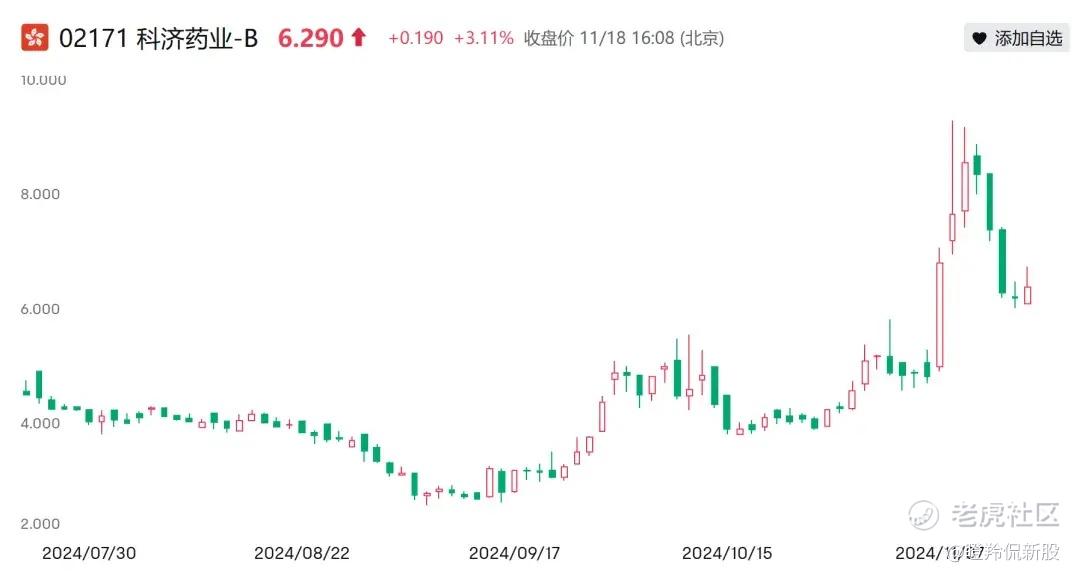
拥有巨大的待扩展市场的新型药物,可不只有双抗,还有一个“尘封”多年的领域,细胞治疗。近日,科济药业凭借着其通用CAR-T疗法的初步研究者发起的临床研究(ITT)数据,使得公司在短短三天内最高录得近100%的涨幅,让投资者看到了通用CAR-T未来的巨大潜力,“聪明的”投资者需要前瞻性的注意到这一领域的机会。
01 通用型CAR-T的挑战和未来空间
目前,全球已上市的CAR-T产品均为自体CAR-T疗法,不仅生产成本昂贵、制备时间较长(长达1个月左右),并且长期局限于血液瘤适应症,可及性仍有极大的提升空间。
通用型CAR-T疗法被业界视为解决自体CAR-T疗法的优解之一,最核心是其能够做到“现货供应”,单次生产可治疗100多名患者,从成本端、时效性等各个层面破除自体CAR-T疗法的局限性。
据第三方数据统计,通用型CAR-T凭借规模化生产的优势,预计可将耗材总成本从6万美元降至2000美元,将QC费用从3万美元降至1000美元,从而将生产成本从定制自体CAR-T疗法的近10万美元降低至4460美元。
不过,通用型的CAR-T目前也面临着不同的研发挑战,可以主要总结为三个层面:
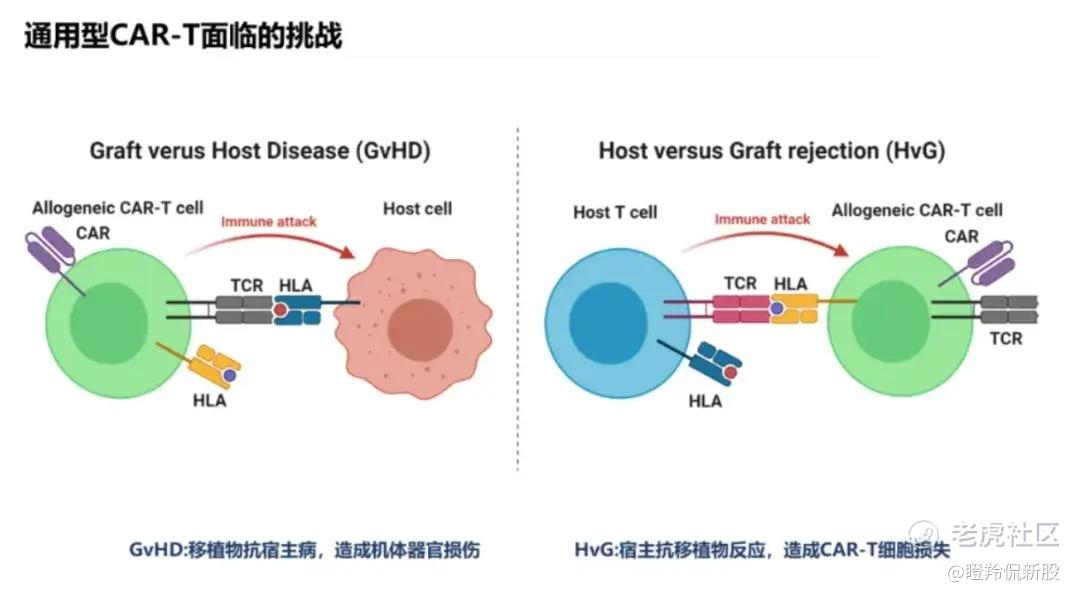
1)移植物抗宿主病(GvHD):异体T细胞TCR识别健康细胞的HLA(人类白细胞抗原)而诱发针对患者健康细胞的攻击,引发患者全身多系统损害的疾病,造成安全性风险;
2)宿主抗移植物反应(HvGR):同样,患者自身T细胞的TCR如果识别到异体CAR-T细胞的HLA而对异体CAR-T细胞发动攻击,但如果采用敲除异体CAR-T细胞HLA的方法,患者其他免疫细胞如NK细胞亦会对其发动攻击,引发HvGR;
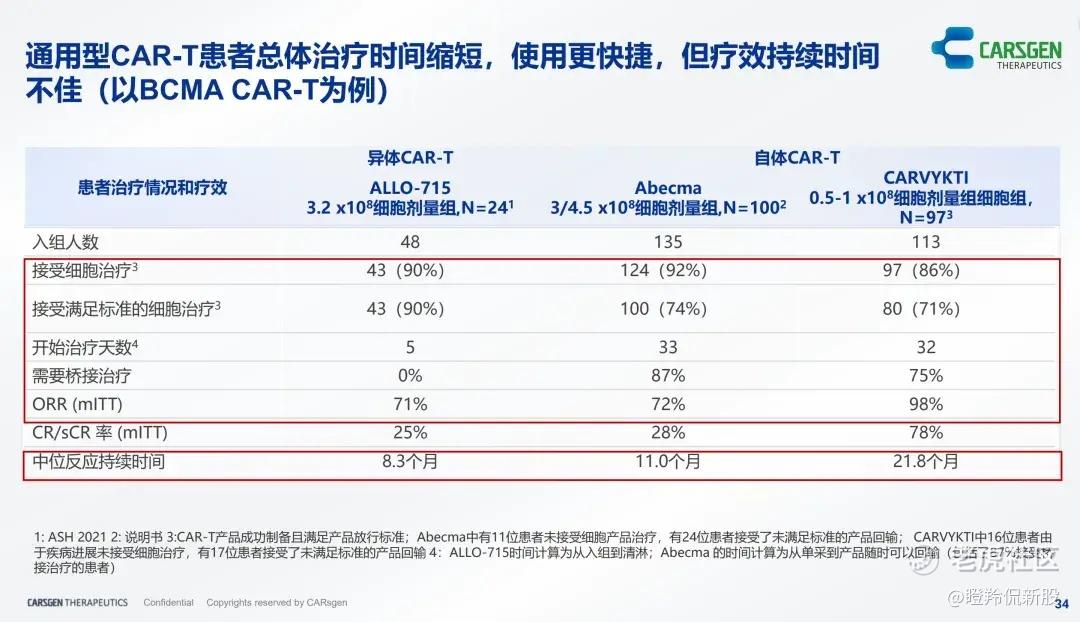
3)疗效持久时间:HvGR延伸出来的问题是影响异体CAR-T细胞在患者体内存活,导致相关CAR-T在患者体内扩增峰值显著降低,治疗持续时间缩短,目前大量通用CAR-T产品未能解决“6个月复发魔咒”。
(图源:茂行生物)
若能通用型CAR-T疗法能够解决上述主要痛点,未来潜力不可估量,近来该领域好消息频传。
2024年10月,邦耀生物在《Cell》发布了全球首个利用CRISPR-Cas9基因编辑技术改造异体通用型CAR-T治疗自免疾病的临床结果,临床数据显示其帮助2名系统性硬化症、1名免疫介导的坏死性肌病患者达到长期缓解。
实体瘤领域,Allogene在2023 AACR大会上公布了其靶向CD70通用CAR-T产品ALLO-316治疗表达CD70的肾细胞癌(RCC)患者早期数据,取得了疾病控制率(DCR)100%、客观缓解率(ORR)30%(肿瘤显著缩小)的优异成果。
在传统自体CAR-T优势领域血液瘤层面,如小分子化疗药物多款产品能够在如多发性骨髓类中取得合计破百亿美元的年销售额,随着通用CAR-T成本下降以及开始在后线治疗取得突破,未来极有望成为新的重磅炸弹孵化器。
通用CAR-T的前途,不可限量。
02 目前通用CAR-T解题的最优解?
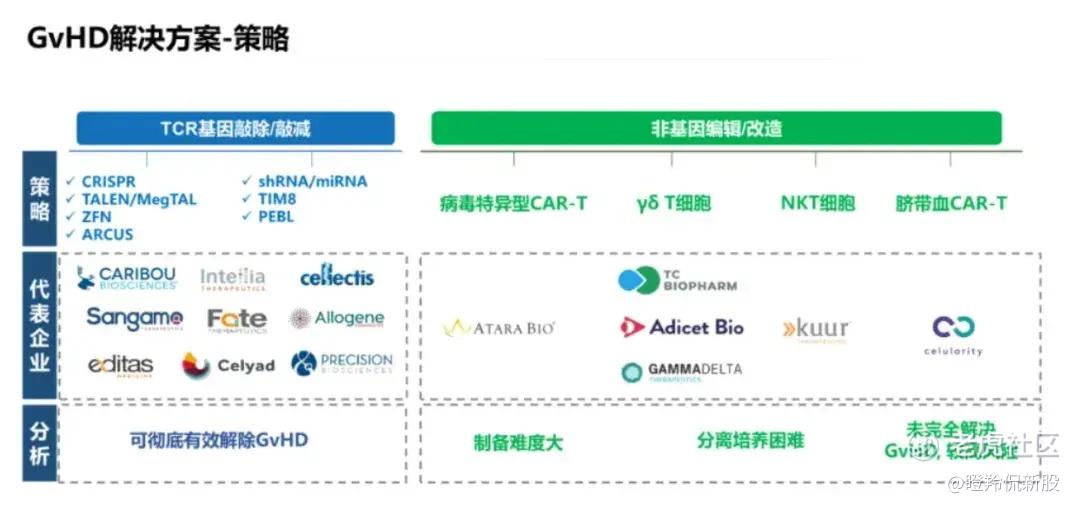
目前,全球研发者针对通用CAR-T可能引发GvHD的难题衍生出了多种解决办法,可以分为基因改造和非基因改造两大类别,基因改造一般指通过彻底敲除或减弱异体T细胞的TCR基因来有效避免GvHD,主流技术包括CRISPR、TALEN、ARCUS、ZFN、 shRNA抑制基因表达、TIM抑制TCR信号转导等;非基因编辑技术来实现目标则是包括病毒特异型记忆T细胞、非αβ T细胞(γδT细胞)、NKT细胞、脐带血CAR-T等方法,但这类方法往往存在制备难度大、无法完全解决GvHD风险等局限性,所以目前全球通用CAR-T主流在研企业大多数使用基因编辑中的CRISPR技术进行异体T细胞的改造。
(图源:茂行生物)
避免GvHD的风险固然重要,但更难的是解决HvGR问题,目前已经看到少数Biotech通过多重基因敲除方式的来解决此类问题。
最典型的例子莫过于科济药业最新公布THANK-uCAR®技术平台以及其管线CT0590的IIT数据。
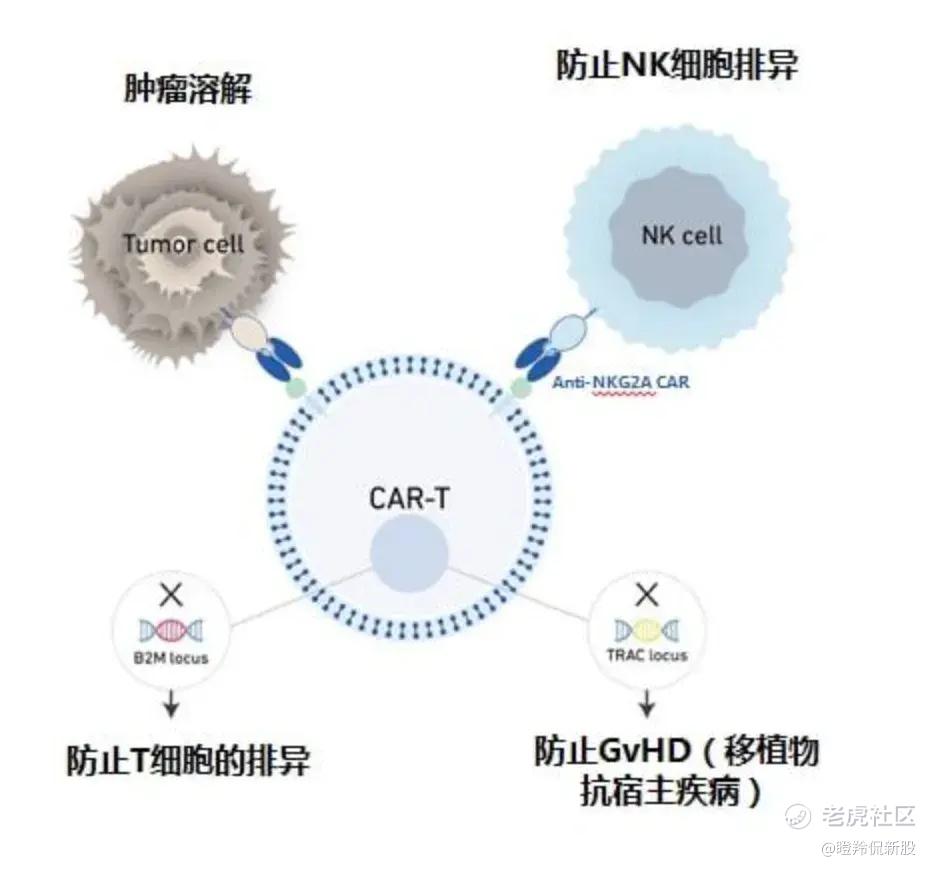
科济药业THANK-uCAR平台开发的通用CAR-T细胞采用了三重基因敲除来应对免疫排斥:
1)敲除TRAC,通过降低T细胞受体表达来减少GvHD,这是普遍通行的思路,不再赘叙;
2)敲除B2M,这能够降低宿主T细胞的排异反应同时减少HvGR风险,但也会导致异体CAR-T细胞丧失被NK细胞攻击的自我“保卫功能”;
3)敲除NKG2A,增强通用CAR-T产品的抗肿瘤功能,并且科济药业在CAR-T表面装载一个能够识别NK细胞表面NKG2A蛋白的CAR作为反击NK细胞的工具。
敲除B2M/NKG2A的“双重”设计,使得THANK-uCAR开发出来的产品能够解决宿主T细胞、宿主NK细胞排异风险。临床前数据显示,在NK细胞存在时,科济药业CT0590具有更强的小鼠体内抗肿瘤能力。
从CT0590的ITT临床数据看,科济药业三重基因敲除的策略取得显著的成果,一方面在16.6个月的中位随访时间中5位患者中的3位确认了客观缓解(其中2例患者达到严格意义上的完全缓解),其中一名DOR已达23个月、一名原发性浆细胞白血病患者DOR为20个月,体内扩增峰值可媲美自体CAR-T(在2名达到sCR患者CAR拷贝数峰值与BCMA CART相当);另一方面,临床中接受CT0590治疗的患者安全性良好,未出现3级及以上细胞因子释放综合征(CRS),未出现GvHD和没有出现出现剂量限制毒性(DLT)等安全性信号。
科济药业THANK-uCAR平台的潜力,投资者能够从CT0590的ITT数据中窥见“破局”通用CAR-T疗法难题的潜力,不过其ITT样本量较小,需要更大的样本量临床进行验证。
放眼海外通用CAR-T疗法的先行者,如前述Allogene公司,其同种异体BCMA CAR-T产品ALLO-715采用了TALEN技术实现TRAC和CD52的双重敲除,最大限度地降低GvHD的风险,同时还配合CD52抗体对患者进行预处理(清淋),为通用型CAR-T提供足够的时间进行扩增。在国内,北恒生物有产品也采用了类似的技术路线。
国内采用多重敲除策略的典型公司还有邦耀生物,其采用了CRISPR-Cas9基因编辑工具敲除CAR-T细胞中的5个基因(HLA-A、HLA-B、CIITA、TRAC和PD-1),其产品展现出有效降低异体CAR-T治疗中存在GvHD和HvGR风险的潜力。
03 通用型CAR-T潜在BD所需特质
CAR-T领域最为投资者津津乐道的可能是阿斯利康全资收购亘喜生物的经典案例。
就亘喜生物的自身基本面而言,其“平台”价值显著。
针对目前自体CAR-T存在的问题,亘喜生物构建了不同的技术路径进行多领域的覆盖,解决CAR-T生产时间问题有FastCAR平台(次日生产),解决实体瘤问题有SMART CART平台,打造同种异体疗法有TruCAR平台等等。
以亘喜生物的TruCAR平台为例,其采用双特异CAR设计,一条CAR用于“保护”异体T细胞不被宿主的T细胞和NK细胞排异,另一条CAR则用于靶向肿瘤抗原以清除肿瘤细胞。基于该项设计,公司TruCAR平台的产品不需要联合CD52抗体使用,降低了免疫治疗可能带来的潜在副作用。
另外为了最大限度降低GvHD和HvGR风险,公司用基因编辑工具敲除TRAC和CD7,CD7是pan T和NK细胞上广泛表达的蛋白分子,为了防止CAR-T细胞间自相残杀。
EBMT 2023大会上,亘喜生物CD7 CAR-T产品GC027(TruUCAR-T平台产品)公布了T细胞急性淋巴细胞白血病(T-ALL)的一期临床数据,12例患者中有11例患者在CAR-T细胞输注后1个月内达到完全缓解(CR)或伴血液学不完全恢复的CR,CR率为91.7%。不过,后续有4例患者在5-10个月内出现复发,1例患者严重感染死亡。
在通用CAR-T先行管线早期数据陆续出路背景下,通用CAR-T的Biotech们还需要解决海外买家们的很多疑惑,不局限于疗效、持续时间和安全性等。
首先是持续时间的问题,Allogene、CRISPR Therapeutics、Precision Biosciences等几家公司候选产品的临床在6个月的时间里出现了一定比例的复发患者;其次便是疗效强度问题,目前有相当一部分通用CAR-T管线的ORR低于自体CAR-T、CR率也较低,并且CAR-T细胞扩增峰值显著低于自体疗法;最后安全性层面,如何有效降低GvHD和HvGR风险,同时降低产品治疗带来的CRS等副作用也是需要思考的一个难题。
(科济药业路演PPT)
结语:对于国内的通用CAR-T研发企业而言,如何解决上述问题算是“任重而道远”,但无可置疑的是,如果国内Biotech的通用CAR-T管线能够顺利在早期数据中做出优异的结果,那么无论是BD还是被并购,都是水到渠成的。
毕竟这个领域的市场,足够大。 $科济药业-B(02171)$ $阿斯利康(AZN)$ $药明巨诺-B(02126)$

精彩评论