老靶点恒久弥新。
小分子EGFR已经用三代养“N家”企业的爆种潜力令投资者赞叹,而Her2、Trop2同样长时间在舞台中央绽放光芒,有一个最被低估的老靶点c-Met的潜力也在慢慢显现。
2023年开年,宜联生物和罗氏达成的价值超10亿美金c-Met ADC授权交易,也让全球众多的投资者将目光聚焦在这一老而热门的靶点上。
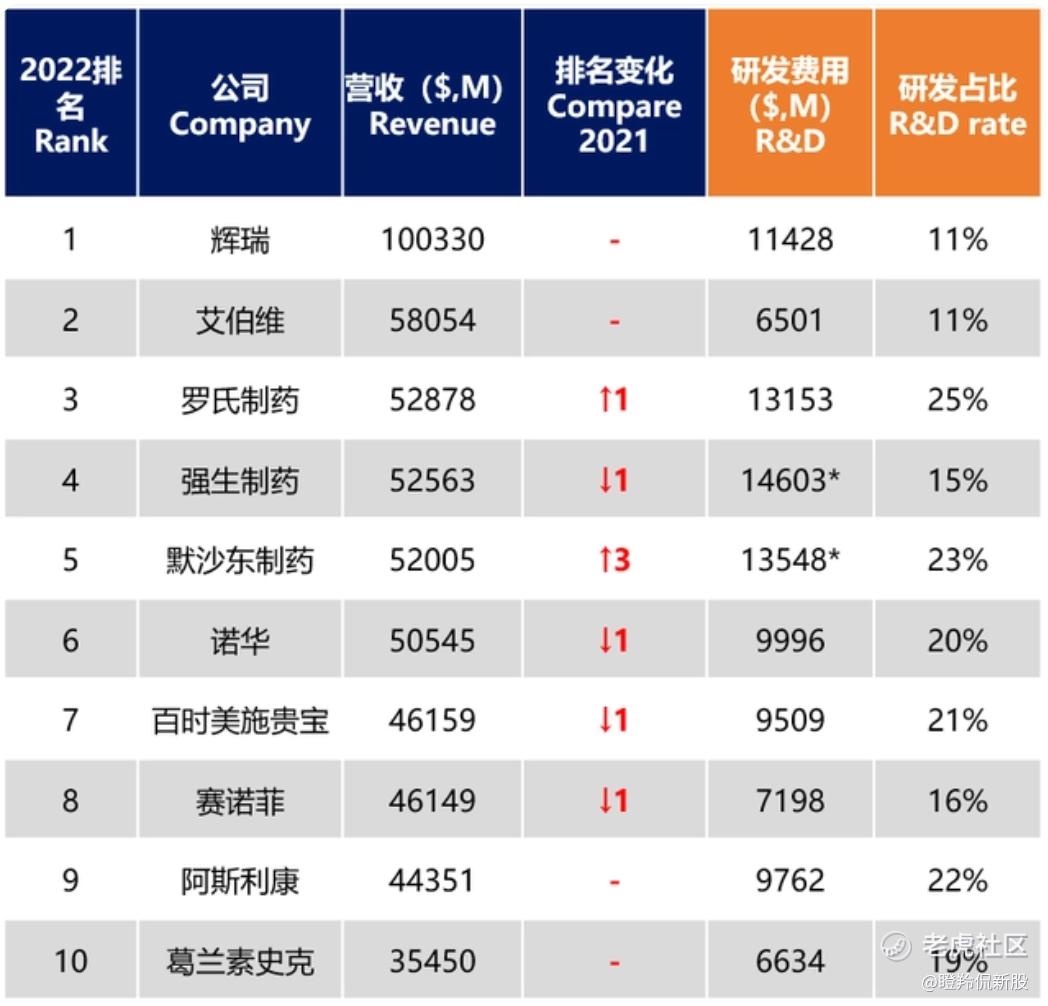
纵览2022年排名全球十大跨国药企,仅有赛诺菲和BMS两家未有针对c-Met靶点的管线布局,其他8家大药企布局的药物形式包括小分子、双抗、ADC乃至双抗ADC等,堪称“兵家必争之靶点”。
(图源:MedTrend)
巨头们争相布局的c-Met靶点,其市场空间、魅力何在?
01 人手一个,c-Met靶点的作用机制与魅力
c-Met是一个重要的受体酪氨酸激酶(1984年被发现),对应配体为肝细胞生长因子,c-Met参与人体的多种细胞信号传导通路,对细胞生长、迁移、侵袭和血管生成等过程发挥重要作用。
研究发现,当c-Met信号通路异常激活或者突变时可能导致多种癌症、耐药、肝纤维化和炎症性疾病的发生,主要表现形式为:c-Met过表达、c-Met基因扩增和c-Met基因突变等。
1)消化道癌症基因异常表达:研究发现在肝癌、肺癌、胃癌、结肠癌、乳腺癌、前列腺癌等多种恶性肿瘤中观察到c-Met失调,尤其在消化道癌症中c-Met基因异常表达率极高,中国是消化道癌症高发的大国,其中胃癌病人c-Met基因突变阳性率约为25%,结直肠癌病人c-Met基因突变阳性率约为15.3%。
2)EGFR耐药:研究发现,c-Met基因扩增不仅在胃癌和食管癌出现,也会在一些EGFR抑制剂耐药的肿瘤细胞中被激活(与EGFR抑制剂耐药性关联),并且其激活会促进细胞生长和转移能力。
3)Met 14外显子跳跃突变:Met 14外显子跳跃突变在非小细胞肺癌(NSCLC)患者中的发生率约为0.9-4%,由于非小细胞肺癌患者群体巨大,0.9-4%患者群体仍不可小觑;而在肺肉瘤样癌患者中,其发生率更高,达到了31.8%;往往Met 14外显子跳跃突变NSCLC的恶性程度更高,更易复发,生存预后更差。
正是因为c-Met信号通路异常激活与多个癌症的发生有关,尤其还集中在肺癌、胃癌等多个大适应症,这为c-Met靶点相关药物的研发提供了无限广阔的前景,也为其中的优异管线未来成为顶级爆品埋下了伏笔。
02 顶级爆品的潜力
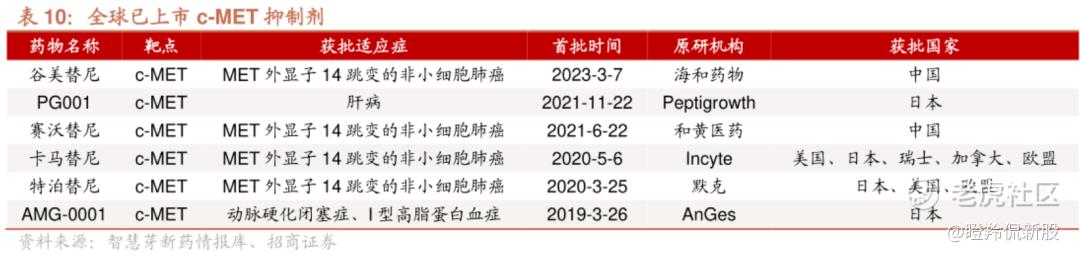
尽管目前尚无c-Met单抗获批上市(安进、罗氏被寄予厚望的分子相继失败),但小分子c-Met抑制剂已经呈现多极化的竞争格局。
目前,全球有超过6款c-Met小分子抑制剂获批上市,主要适应症集中在Met 14外显子跳跃突变的非小细胞肺癌。其中,卡马替尼是当前销售额领先的c-Met抑制剂,2022年销售额为1.3亿美元,有分析师认为:卡马替尼销售峰值将达到10亿美元以上。
国产c-Met抑制剂同样不甘示弱,和黄医药赛沃替尼2022年销售额为4120万美元,并已有研究数据表明:三代EGFR-TKI王者奥希替尼耐药患者约有30%出现Met扩增,赛沃替尼加入治疗能够逆转奥希替尼耐药,这显然能够提升赛沃替尼未来的销售峰值。
不过,c-Met小分子抑制剂也存在较大的局限性,一方面需要根据不同的Met突变设计不同的信号通路抑制剂,另外一方面c-MET与TKIs之间的串扰是可能使患者对c-MET抑制疗法产生抗性,最后可能是小分子通病-耐药性。
小分子之后,c-Met靶点的新型分子也陆续上岸,拥有顶级爆品的潜力。
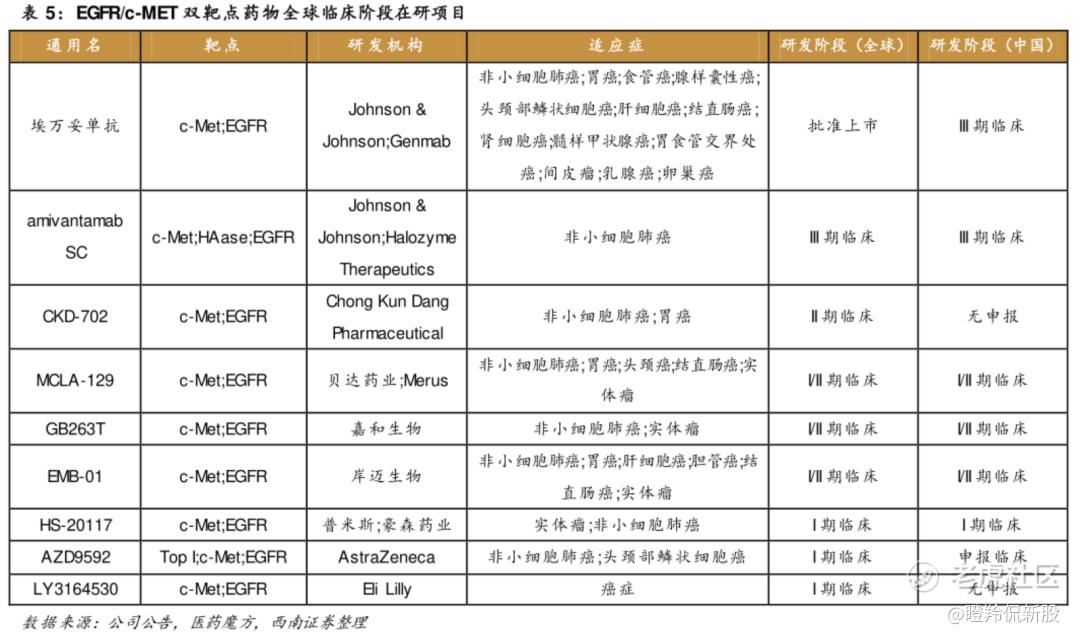
率先上岸的是强生的EGFR/c-Met双抗埃万妥单抗,不仅在2021年凭借Ib期数据被FDA批准首携带EGFR外显子20插入突变的局部晚期或转移性非小细胞肺癌,并后续在奥希替尼耐药后的NSCLC患者三期临床获得成功,成功的率先突入第三代EGFR-TKIs耐药和EGFR非经典突变的巨大治疗市场空白。由此,强生在2023年12月的研发日上,也立下了埃万妥单抗在肺部疾病组合销售峰值为50亿美元的豪言壮志。
ADC作为精准化疗的代名词,同样具备成就爆品的潜力。目前,靶向c-Met的ADC临床进度最快的是艾伯维ABBV-399(进入临床三期),在其临床二期LUMINOSITY试验顶线数据显示:在c-Met高、中表达的EGFR野生型NSCLC患者中,治疗组中位缓解持续时间(DOR)分别为9个月和7.2个月,mOS分别为14.6个月和14.2个月,ABBV-399有望成为小分子靶向药耐药后的c-MET高表达患者的一种全新的治疗方案。
在众多早期分子中,最备受行业投资者期待的莫过于阿斯利康EGFR/c-Met双抗ADC管线AZD9592。为何市场对AZD9592如此期待?不仅仅是因为阿斯利康是奥希替尼的研发者,还因为AZD9592的FIC药物特性和独特的机制。
AZD9592临床前结果显示:其在EGFR 19号外显子突变、EGFR 21号外显子突变和多种EGFR非典型突变的PDX模型下均观察到肿瘤消退;另外,对c-MET具有更高的亲和力(降低毒性),同时在临床低试验剂量2 mg/kg组中,在EGFR突变NSCLC患者中给出了41%的响应率。人们在AZD9592身上,看到了一个“更好的埃万妥单抗”。
03 尚未BD的国产分子
从欧美回到国内,会发现国内仍处于小分子EGFR、c-Met抑制剂狂欢又内卷的时代。
2017年开始逐渐向第二代、第三代EGFR抑制剂逐渐占据国内主流市场,不仅诞生了阿斯利康奥希替尼这样的重磅大单品,投资者们也见证了伏美替尼的异军突起,仍有更多的第三代EGFR抑制剂正在冲击商业化,市场竞争逐渐内卷化。
反观c-Met抑制剂,目前有和黄医药的赛沃替尼、海和药业的谷美替尼和默克的特泊替尼同台竞技,让c-Met抑制剂本来就不大的市场空间更加拥挤。
可以肯定的是,未来国产c-Met相关管线对外授权的绝大多数BD机会在于大分子及相关新药物形式。
c-Met单克隆抗体领域,原本进入临床阶段的分子还有复宏汉霖的HLX55,可能由于多个大厂的接连失败和成药性迷茫的前景,c-Met单抗管线HLX55已经消失在复宏汉霖最新的管线体系图中。另外,EGFR/c-Met双抗的大获成功带来的挤压,也让单抗潜在兴趣买家锐减。
EGFR/c-Met双抗及多抗方面,进入临床阶段的分子包括贝达药业与荷兰Merus共同开发EGFR/cMET双抗的MCLA-129、嘉和生物自主研发的EGFR/cMET/cMET三抗GB263T、岸迈生物自主研发的EGFR/cMET双抗EMB01、普米斯和翰森药业共同开发的EGFR/cMet双抗HS-20117。
国产几家竞争者临床推进速度不分伯仲,从已披露数据的嘉和生物GB263T海外一期临床数据看,在三代EGFR-TKIs耐药患者中,治疗组ORR为40%,DCR为60%。
在全球靶向c-Met的ADC在研临床管线中,同样出现了两道国产厂商的身影,分别是恒瑞医药的SHR-A1403(国内最先进入临床)和荣昌生物的RC108。
据临床前数据显示,恒瑞医药SHR-A1403定位于艾伯维ABBV-399管线的me-better,不仅采用定点偶联技术使得ADC均一性更加好,同时药物使用的是恒瑞自己的化学药物SHR153024,安全窗口较ABBV-399的偶联药物MMAE高64倍。
在靶向c-Met的新型分子领域纵使是大厂也有很高折戟的概率,上述国产分子如果在未来失败也并不意外,但一旦临床数据积极,BD的概率将成几何倍数提升。
结语:在巨头的兵家必争之地(靶点),我们希望有更多的国产分子,能够被纳入巨头们的“购买清单”。 $恒瑞医药(600276)$ $荣昌生物(09995)$ $翰森制药(03692)$

精彩评论