手握新型ADC、TCE多抗的天命Biotech
8月21日,乐普生物发布2024H1业绩报告:上半年公司录得收入1.33亿元,较去年同期增长一倍,主要源于PD-1普特利单抗的销售增长,实现收入约0.95亿元,同比2023H1的0.44亿元增长115.45%。由此可见,乐普生物销售渠道已基本构建覆盖一个网络,商业推广有序推进,业绩有望保持长期稳健。MRG003预计年内申报,则有望成为国内首款EGFR ADC,随着其未来商业化的兑现,公司差异化ADC龙头的地位也得以确立。
如今,乐普生物就像一颗蓄势的火山,将要迎来属于自己的腾飞时刻。除了一系列即将商业化和推进至关键性临床的ADC管线群,BIC、FIC创新分子如潮水般的输出,也进一步印证了公司创新研发平台强大的研发能力,未来造血将更加多元化。
未来十年注定是ADC、多抗共舞的时代。
ADC、多抗作为过去化疗和现在IO单抗的各自迭代,2024H1分别实现了60亿美元、63.5亿美元的全球销售,更是创造了如HER2 ADC德曲妥珠单抗(2024H1销售17.72亿美元)和VEGF-A/Ang-2双抗法瑞西单抗(2024H1销售20.27亿美元)这样的新重磅炸弹,两大领域俨然行齐头并进之势。
常言道:“选择对的方向,比努力更加重要。”
这意味着若Biotech能同时掌握ADC、多抗两大领域的研发脉络,无论是商业化还是出海都前景可期。而如若要问哪家Biotech在未来最有可能获得时代的垂青,在新一代ADC和多抗技术平台拥有前瞻性布局且领先的乐普生物必定位列其中。
01 先行产品群,加速进入商业化、临床后期
乐普生物继PD-1普特利单抗商业化放量后,EGFR ADC产品MRG003也即将成为公司下一个商业化更强劲的创新品种。
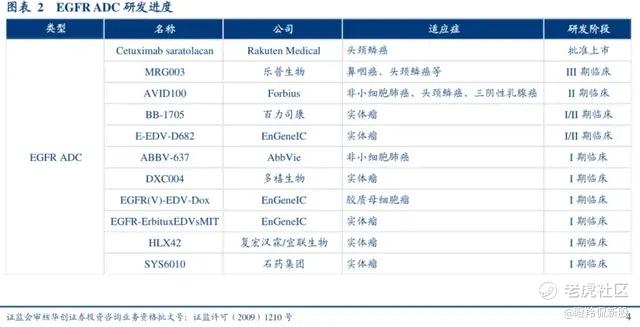
MRG003在2023年底已完成注册临床的入组,目前处于随访阶段。公司预计在年内将完成NDA的申报,最快2025年获批上市,有望成为国内首个获批的EGFR ADC。
全球范围内目前仅有一款EGFR ADC获批上市,为日本厚生省批准的光敏ADC产品ASP-1929,用于二线头颈鳞癌。乐普生物MRG003是国内乃至全球临床进度最快的EGFR ADC,而从现有国内管线,其鼻咽癌适应症在短时间内不会遭遇强有力的挑战。
鼻咽癌虽然不算是一个大适应症,但不可小觑其开发潜力。据2020年全球癌症数据统计,全球鼻咽癌新发病例约13.3万例,其中国内新发病例就高达6.24万例,占到全球新发病例近50%。早期患者接受根治性手术和局部晚期接受放化疗患者5年生存期分别高于95%、75%,这意味着国内存量的一二线鼻咽癌患者至少超过20万人。除了新发病例外,这些存量病例均为MRG003的潜在使用患者。
无论是一线和二线后的鼻咽癌治疗,MRG003及免疫治疗组合的疗效与安全性均展现出远超现有标准疗法的潜力。
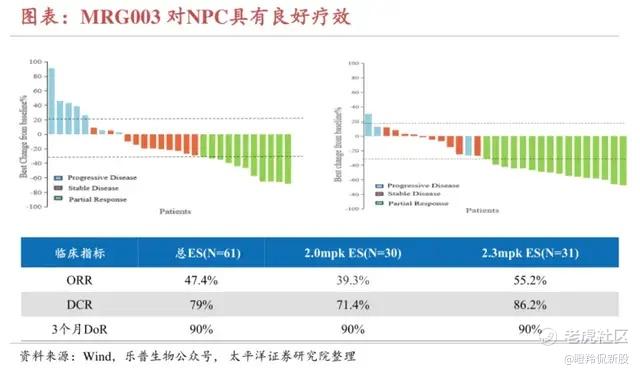
乐普生物在2023 ESMO最新公布的MRG003治疗二线鼻咽癌的IIa期数据显示:在61例可评估患者中,2.0mg/kg剂量组ORR为39.3%,DCR为71.4%;2.3mg/kg剂量组29例可评估疗效,ORR为55.2%,DCR为86.2%。对比单药化疗、PD-(L)1针对二线及以上鼻咽癌患者只有20-30%的客观缓解率,MRG003有望成为二线及以上鼻咽癌最佳治疗药物。
MRG003冲击一线治疗也不在话下,目前2024 CSCO指南一线治疗鼻咽癌为PD-1联合吉西他滨联合顺铂(GP化疗方案),其ORR普遍在60-80%不等,而三级以上不良反应率超过80%。在乐普生物MRG003联合PD-1普特利单抗探索实体瘤的一期临床数据显示,9名PD-1+化疗经治EGFR阳性患者的ORR为77.8%、DCR为100%,严重不良反应发生率仅为12%(与MRG003单药治疗二线及以上鼻咽癌患者的IIa期临床相近),这意味着未来MRG003联合PD-1普特利单抗将有很大概率挑战现有的一线治疗标准。
除了鼻咽癌适应症,乐普生物的在2023 ESMO大会最新头颈癌二期临床数据显示:PD-1/L1抗体耐药二线头颈癌患者中,接受2.3mg/kg MRG003治疗组ORR为43%、DCR为86%,mPFS为4.2个月,mOS为11.3个月,相比PD-1/L1抗体在同类病人仅有6-7个月的OS,疗效亦具突破性。
MRG003卓越的疗效和关注未满足临床需求的特性,也使得其海外兑现预期的进一步加强。
本月初,MRG003获得了FDA的突破性疗法认定认定(BTD),此前MRG003治疗复发/转移性鼻咽癌适应症已经拥有了FDA孤儿药、快速通道两大特殊认定,这不仅代表药物的创新性和突破性获得FDA认可,同时这些认定可以加速转化成优先审评和加速审批,为药物未来的快速海外推进打下基础。基于MRG003先发优势及在两大适应症上的潜力,预计该品种国内销售峰值可能超过20亿。
乐普生物的ADC管线在消化道和胰腺癌领域的实力强劲。
目前,乐普生物/康诺亚共同开发的CLDN18.2 ADC管线CMG901已将海外权益授权给阿斯利康(AZ),AZ已在全球启动治疗晚期或转移性胃癌的全球三期临床,成为首个开启全球大三期临床的CLDN18.2 ADC。另外,乐普生物在中报管线图中也出现了一个新的分子代号MRG007,也是针对CRC适应症靶点的一个ADC候选药物,预计在2025年进行IND的申报。
更令人期待的是乐普生物的TF ADC管MRG004A,其不仅是临床进度全球前二的TF ADC,同时在适应症布局上与全球首款获批产品Tivdak差异化布局,在“癌王”胰腺癌上呈现出大量潜力。
在胰腺癌领域,MRG004A方面,在ASCO大会最新公布的I/II期临床数据显示,在12名中位治疗线数为3的胰腺癌患者中,有4例部分缓解(PR)和6例疾病稳定(SD),整体ORR为33.3%,DCR为83.3%。其中在TF高表达(TF≥50%)、3+强度及既往接受二线或以上治疗的5例胰腺癌患者中, ORR及DCR分别为80%及100%,mPFS为5.5个月。
02 全新ADC平台,诞生First in class的温床
乐普生物的全新ADC研发平台Hi-TOPi,极可能成为下一代同类首创和同类最佳ADC的孵化温床。
目前这一代ADC的研发仍存在不少的问题,主要包括Payload的效力、靶点表达异质性、Linker不稳定导致的脱靶毒性(提升安全性)、关乎用药时长的耐药性等等。
乐普生物的Hi-TOPi平台对于ADC各个部分的核心零部件都进行了全面优化,包括抗体、Linker和Payload等:抗体层面,乐普生物Hi-TOPi有能力筛选出对目标靶点亲和力更强、内吞更快的抗体;Linker层面,Hi-TOP平台的连接体在血液循环中高度稳定并在肿瘤细胞中高效释放,用该连接体链接Payload的ADC在多种肿瘤类型的PDX中展现出很强的肿瘤活性;Payload层面,具有优于对手的良好潜力(非Pgp的底物,具有克服耐药性的潜力)。
乐普生物最新进入临床阶段的ADC管线MRG006A ,其实切实向市场展现了乐普生物 Hi-TOPi技术平台量产FIC或BIC的实力。
MRG006A虽然未公布其结构和具体采用的Linker,但乐普生物透露了这是一款DAR为8的ADC,与过去采用Val-Cit(缬氨酸-瓜氨酸)ADC的DAR普遍为4不同。有效载荷越多,那么解决体内毒性的问题就极为关键,目前尚未能看到Hi-TOPi平台提升Linker在血液循环中的稳定性、改善ADC治疗窗口层面优化措施的优异性,但有效载荷的优化不乏出现一些端倪。
药物外排泵是耐药的主要形式之一,多药转运体P-糖蛋白(Pgp)是一种ATP结合盒式外排体,这些糖蛋白导致了细胞膜渗透性变差,从而介导了化疗阶段的耐药,ADC的有效载荷同受此影响;而采用的有效载荷并非Pgp的底物,使其避开了上述耐药的机制。临床前效力展现层面,相比临床阶段的抗体,MRG006A对GPC3 阳性肿瘤细胞有更强的结合力,且在多个不同GPC3表达水平的肝癌CDX模型和PDX模型中均表现出强大且剂量依赖的抗肿瘤功能。
在靶点的选取上,乐普生物的MRG006A也的确慧眼如炬。
GPC3在正常成人组织中几乎不表达,而在超70%的HCC组织中高表达,并以可溶性GPC3(sGPC3)的形式出现在HCC患者的外周血中,这显然是一个很适合做ADC分子的靶点。
目前全球靶向GPC3的研发管线不少,但主要以抗体和CAR-T管线为主,但目前均未出现确证性大样本的临床数据,同时CAR-T的可及性也给后来的GPC3双抗和ADC新型药物带来了更多差异化的竞争机会,这个靶点全球处于群雄逐鹿的阶段。
从全球GPC3 ADC研发格局来看,MRG006A在今年7月取得IND批件,8月完成FPI,I 期临床入组中。
03 乐普生物领跑“ADC+免疫”新时代
全球“ADC+单抗”和“ADC+多抗”联用之风已逐步兴起。
MNC巨头中,罗氏率先利用自家的CD79b ADC和CD3/CD20双抗组合疗法探索在复发性/难治性非霍金奇淋巴瘤上的疗效;8月6日,默沙东和第一三共扩大合作,在三种在研DXd ADC药物之外添加默沙东的在研多抗MK-6070,旨在探索旗下ADC与T细胞嵌合器MK-6070的联用疗效。
乐普生物新一代T细胞衔接器平台TOPAbody的发布,切切实实走在了时代的前沿。
据乐普生物介绍,TOPAbody特点包括在特异性肿瘤相关抗原存在的情况下,同时启动TCR信号和4-1BB介导的共刺激途径(旨在释放T细胞的所有潜能),以改善实体肿瘤微环境对于T细胞的活性限制。
TOPAbody平台可以算得上现有T细胞嵌合器CD3双抗的“升级版”,CD3在免疫系统中扮演着关键角色(激活T淋巴细胞),尤其是CD8+T细胞(T杀伤细胞)和CD4+T细胞(T辅助细胞),但有相当一部分肿瘤,其肿瘤细胞内的CD8+T细胞因持续的肿瘤抗原刺激和免疫抑制微环境出现耗竭,单纯CD3双抗起不到非常好的疗效。以小细胞肺癌(SCLC)为例,不少SCLC患者接受CD3/DLL3双抗治疗仍无反应,其主因便是T细胞耗竭及浸润不足。
相比于CD3,4-1BB信号的引入全面提高了T细胞潜能,解决了只有CD3单一信号分子激活而造成T细胞耗竭等问题。此外,4-1BB还能够调整T细胞代谢途径以适应肿瘤微环境,促进T细胞在肿瘤内的增殖及浸润,并诱导机体产生更多的记忆性T 细胞,从而增强免疫细胞对肿瘤的攻击能力,尤其对于PD-1治疗无效的免疫冷肿瘤展现出巨大的应用前景。
据罗氏公布的DLL3/CD3/4-1BB三抗的临床前数据显示:相比DLL3/CD3双抗,DLL3三抗具有更好的抗肿瘤活性和更显著的肿瘤体积缩小,同时其诱导的T细胞活性更高且更持久、细胞毒性更强,这同时也映射了乐普生物TOPAbody平台的先进性和前瞻性。
目前在乐普生物的TOPAbody平台已有相当的数据积累,其产生的TCE抗体拥有特异性更强的结合活性、持久的T细胞激活能力、更强大的抗肿瘤活性等特质,同时其在安全性层面也能够显著减少细胞因子风暴的风险。
TOPAbody平台首个孵化的分子是CTM012(DLL3/CD3/4-1BB三抗),目前已经进入临床申报阶段,我们可以期待一下该分子未来的早期临床数据呈现。
对于手握新一代ADC平台Hi-TOPi和前沿T细胞衔接器平台TOPAbody的乐普生物,无疑站在了时代最前沿的风口,投资者很难不报以美好的期待。新一代的ADC,可以通过抗体的特异性精准的将毒素递送到肿瘤细胞进行杀伤发力,而全新一代的多抗会比现有的双抗更持久的刺激T细胞对肿瘤进行杀伤清除,以达到联用协同作用。
如若乐普生物两大平台的新分子进行组合布局,那么未来的组合疗法潜力和想象力,将远超现有的ADC+PD-1开发计划,扎实的走在时代前沿。
结语:市场投资者近期对于乐普生物的担心和恐慌导致的股价错杀很可能是多余的,尽管现金管道维持在2年左右,但背后还有大股东力量的支持,无论短期和长期均无断粮之忧;而真正应该看到的是,乐普生物目前所拥有的“即将商业化及后期ADC管线的巨大潜力+创新分子平台的巨大价值”,方能体会这家手握ADC+多抗技术平台创新Biotech的真正内在价值。 $乐普生物-B(02157)$ $科伦博泰生物-B(06990)$ $康方生物(09926)$
免责声明:上述内容仅代表发帖人个人观点,不构成本平台的任何投资建议。