HighLife获FDA IDE批准启动治疗二尖瓣返流的美国关键性临床研究
巴黎,2024年6月3日
法国HighLife SAS公司宣布美国食品药品管理局(FDA)批准其研究性设备豁免(IDE)申请,可使用新型经房间隔二尖瓣置换(TSMVR)系统启动一项美国关键性研究。该关键性研究是一项单臂、多中心、前瞻性研究,旨在评估 HighLife TSMVR系统在不适合手术或经导管修复治疗的中度至重度功能性二尖瓣返流(FMR)患者的安全性和有效性,预计将在美国、欧洲和亚太地区的临床研究机构招募患者。
在美国、欧洲和亚太地区的不同临床项目中,已有 100 多名患者接受 HighLife TSMVR 技术治疗;其30例可行性研究的一年随访临床结果已公布于全球性会议,并发表于JACC(美国心脏病学会杂志)心脏介入专刊。
二尖瓣返流与治疗
二尖瓣返流是一个日益严重的公共健康问题,影响超过 2% 的总人口。二尖瓣返流指位于左心腔之间的瓣膜(二尖瓣)不能完全关闭,导致血液回流,从而不能持续为器官供应含氧血液。若没有适当的治疗,重度二尖瓣返流会导致严重的心脏问题甚至心力衰竭,而TSMVR则为传统的开胸手术提供了一种创伤更小的替代措施。
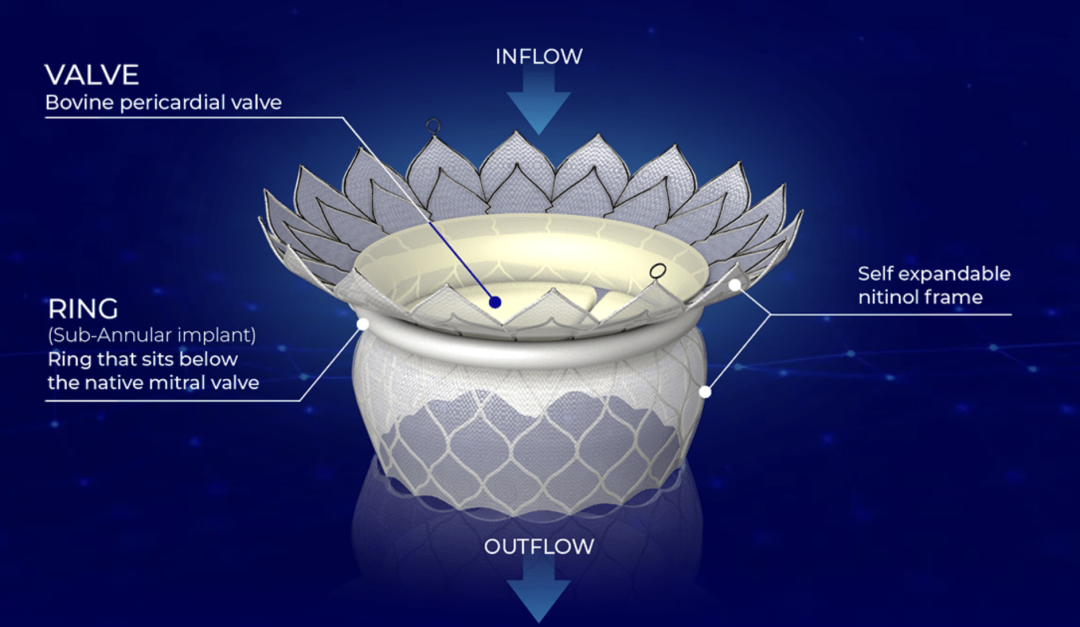
HighLife TSMVR系统采用特有的”Valve-in-Ring”设计理念,利用固定环与人工瓣膜的相互锁定,实现非径向支撑力锚定,具有自适应、自同轴的特点。手术主要包含三大步骤:1. 逆行主动脉路径,利用导丝围绕原生二尖瓣成环;2. 沿导丝轨道完成固定环植入;3. 经房间隔路径植入人工瓣膜。
临床研究随访结果
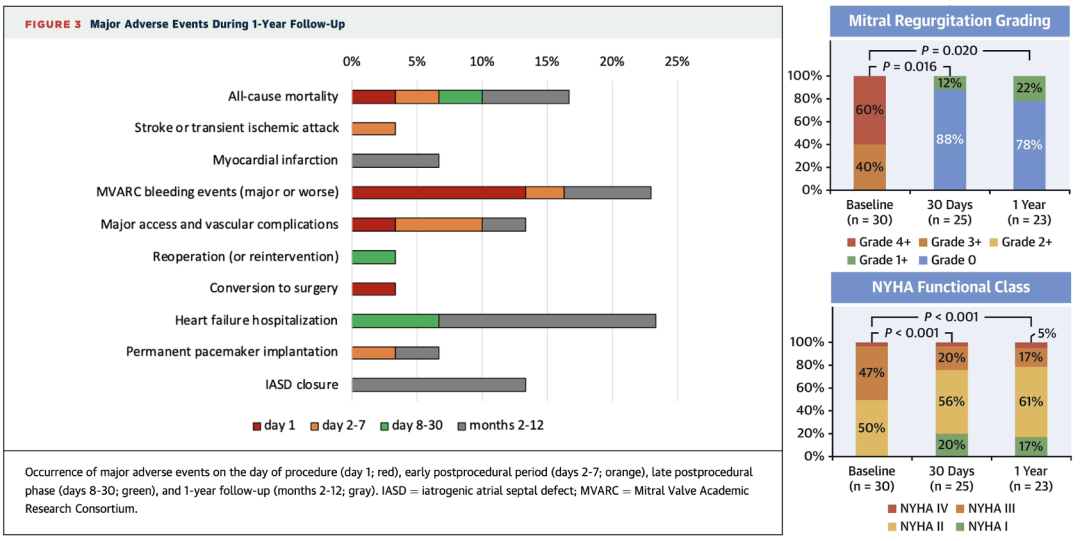
根据HighLife TSMVR 在欧洲/澳洲的可行性试验中30例临床结果, HighLife TSMVR达到了90%的技术成功率,术后1年时患者全因死亡率仅17%,所有患者二尖瓣反流程度均降至轻度及以下,75%以上的患者1年时均保持NYHA I/II级,同时1年时的生活质量(基于KCCQ)亦提升明显。
Gregg W. Stone 教授
美国经导管心血管治疗学术年会(TCT)主席,将担任关键性研究的首席研究员
“我很荣幸能领导HighLife关键性研究。二尖瓣返流患者仍有显著临床需求未得到满足,而 TMVR 是一种很有前景的治疗措施。HighLife TMVR 技术可能为这些高危患者带来重要的临床益处。我们很高兴 FDA 批准了这项关键性研究,这将进一步推动二尖瓣返流患者的治疗。”
Georg Börtlein
法国HighLife SAS公司创始人兼首席执行官
“我们很高兴美国食品药品管理局(FDA)批准我们在美国进行关键性研究的IDE,这是我们美国临床战略的一个重大里程碑。这项批准符合我们在三大洲各临床中心得到的广泛临床数据支持,亦标志着我们CE 认证递交的准备程度愈发完备,期待我们的技术可以早日进入欧洲商业化市场。”
沛嘉医疗简介
沛嘉医疗于2012年成立,总部位于中国江苏苏州,2020年5月在港交所上市(股票代码9996.HK)。公司秉持“至善尽心,敬畏生命”的理念,始终将生命和安全放在首位,深耕技术,坚持创新,竭尽所能助力生命健康。公司定位“创新为本,心脑同治”战略布局,专注于创新、研发及生产结构性心脏病和脑血管介入领域高端医疗器械,涵盖主动脉瓣、二尖瓣、三尖瓣及手术附件,脑血管介入出血类、缺血类、通路类产品,构建起国内结构性心脏病和脑血管介入领域较为全面的产品组合及解决方案。
沛嘉医疗具有其合作方法国HighLife SAS公司授予的TMVR专利产品的独占许可,沛嘉医疗有权在大中华区生产、开发和销售TMVR产品;两家公司对产品升级改进具有交叉实施许可,鼓励其紧密合作、专注于创新、并且共享成果。
法国HighLife SAS公司简介
法国HighLife SAS 公司总部位于法国巴黎,在加利福尼亚州尔湾设有办事处,是一家处于商业化前期阶段的公司,该公司致力于开发治疗二尖瓣返流的新型经导管置换系统。HighLife 开发的 TSMVR 技术采用Valve-in-Ring概念,环及瓣膜均经皮植入。该技术的植入过程简单,分为 3 个步骤;在心脏跳动的情况下置入瓣膜,可减少对患者的创伤。目前正在三大洲开展临床试验。
文章原文

免责声明:上述内容仅代表发帖人个人观点,不构成本平台的任何投资建议。