远大医药全球创新RDC药物TLX591及TLX250-CDx取得临床进展
· TLX591用于治疗前列腺癌的海外III期临床研究呈现积极数据,其放射学无进展生存期(rPFS)中位数为8.8个月;
· TLX250-CDx已完成向美国FDA递交用于诊断肾透明细胞癌(ccRCC)的生物制品上市许可申请(BLA);
· 目前,本集团是进入中国III期临床研究中诊断和治疗类RDC创新药总计储备最多的企业,也是全球范围内在核药抗肿瘤领域拥有最丰富产品管线和诊疗一体化布局的创新药企之一。
近日, $远大医药(00512)$ 在放射性核素偶联药物(RDC)领域的重要战略合作伙伴Telix Pharmaceuticals Limited (Telix, ASX: TLX)的两款全球创新RDC药物取得临床进展:用于治疗前列腺癌的TLX591的海外III期临床研究呈现积极数据,其放射学无进展生存期(rPFS)中位数为8.8个月;以及用于诊断肾透明细胞癌(ccRCC)的TLX250-CDx已完成向美国FDA递交生物制品上市许可申请(BLA)。
TLX591临床优势显著,国际多中心临床进展顺利
关于TLX591及其临床试验:
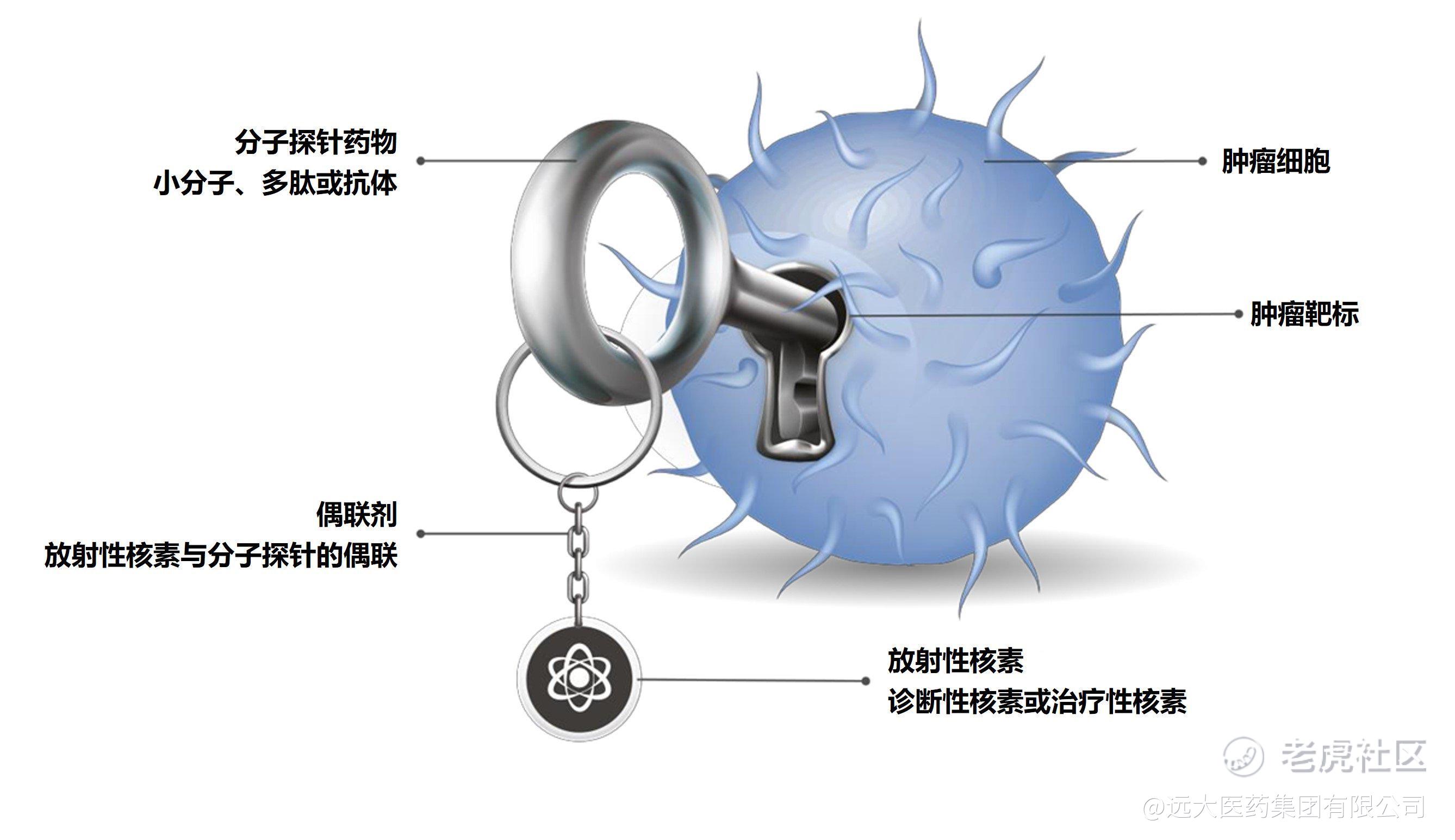
TLX591 (177Lu-rosopatamab tetraxetan)是一款基于放射性核素-抗体偶联技术的靶向前列腺特异性膜抗原(PSMA)的治疗性放射性药物,该产品与本集团另一全球创新RDC药物TLX591-CDx (68Ga PSMA-11)形成了去势转移前列腺癌的放射诊疗一体化组合。
此次ProstACT SELECT临床研究是一项放射基因组学研究,旨在评估基于68Ga的PSMA-PET (正电子发射断层成像)与TLX591剂量测定的病灶的一致性。临床研究报告称,其rPFS中位数为8.8个月,表明TLX591对该患者群体具有潜在疗效。rPFS的可评估样本量包括23名之前接受过治疗的进展性转移性去势抵抗性前列腺癌(mCRPC)患者。
此前TLX591已完成的8项I期和II期临床研究累计共治疗242名患者,证实了最佳分级给药方案的临床有效性和产品的安全性。其中,ProstACT SELECT研究早前的初步数据表明,PSMA具有高度的靶向肿瘤结合能力,并最大限度地减少了肾脏等器官的摄取和毒性问题,同时也证明了177Lu标记的PSMA抗体靶向疗法具有更长的药物留存时间、吸收率、及潜在的疗效获益。
TLX250-CDx获FDA授予突破性疗法,或成美国首个靶向放射性药物成像剂
关于TLX250-CDx及其临床试验:
TLX250-CDx (89Zr-TLX250)是一款全球创新的适用于 ccRCC 诊断的放射性核素偶联药物,其靶点为碳酸酐酶 IX (CA9),CA9 在 ccRCC 和其他许多癌种中过度表达。基于其可能在最常见且最具侵袭性的一种肾癌-ccRCC 的无创诊断以及患者后续治疗与管理决策方面产生重要突破,TLX250-CDx在2020年7月获美国FDA授予突破性疗法认定,因此TLX250-CDx可采用滚动审评机制,按照美国FDA预定时间表逐项提交审评所需模块,目前该产品已完成BLA申请的提交。同时,Telix已就此次BLA申请了优先审评,若获得批准,则将缩短审评时间。若TLX250-CDx成功获批,该产品有望成为美国肾癌领域首个靶向放射性药物成像剂。
TLX250-CDx海外III期临床研究(ZIRCON)于2022年11月成功达到全部主要临床终点和次要临床终点,试验结果显示,对于通过目前临床常用诊断方法电子计算机断层扫描(CT)或磁共振成像(MRI)提示存在肾脏肿块但无法判断是否为ccRCC的患者,TLX250-CDx通过正电子发射断层成像(PET)在诊断ccRCC的敏感性和特异性上分别达到86%和87%,远超过美国FDA要求的预设阈值(敏感性和特异性均大于或等于70%),阳性预测值可达93%。此外,针对目前难以诊断的处于T1a期的早期ccRCC(即肿瘤局限于肾内,肿瘤最大径少于或等于4cm),TLX250-CDx诊断的敏感性和特异性分别达到85%和89%。这些突破性的临床结果表明,TLX250-CDx将有望为临床提供一种准确性高且无创的ccRCC诊断方案,并有潜力成为全新的ccRCC临床诊断标准。
中国临床方面,TLX250-CDx于2022年9月获批开展I期临床试验及确证性临床试验,并于2023年7月完成I期临床试验首例患者入组给药,目前已完成I期临床研究进入确证性临床试验阶段。
持续推进创新产品研发,夯实全球核药领军地位
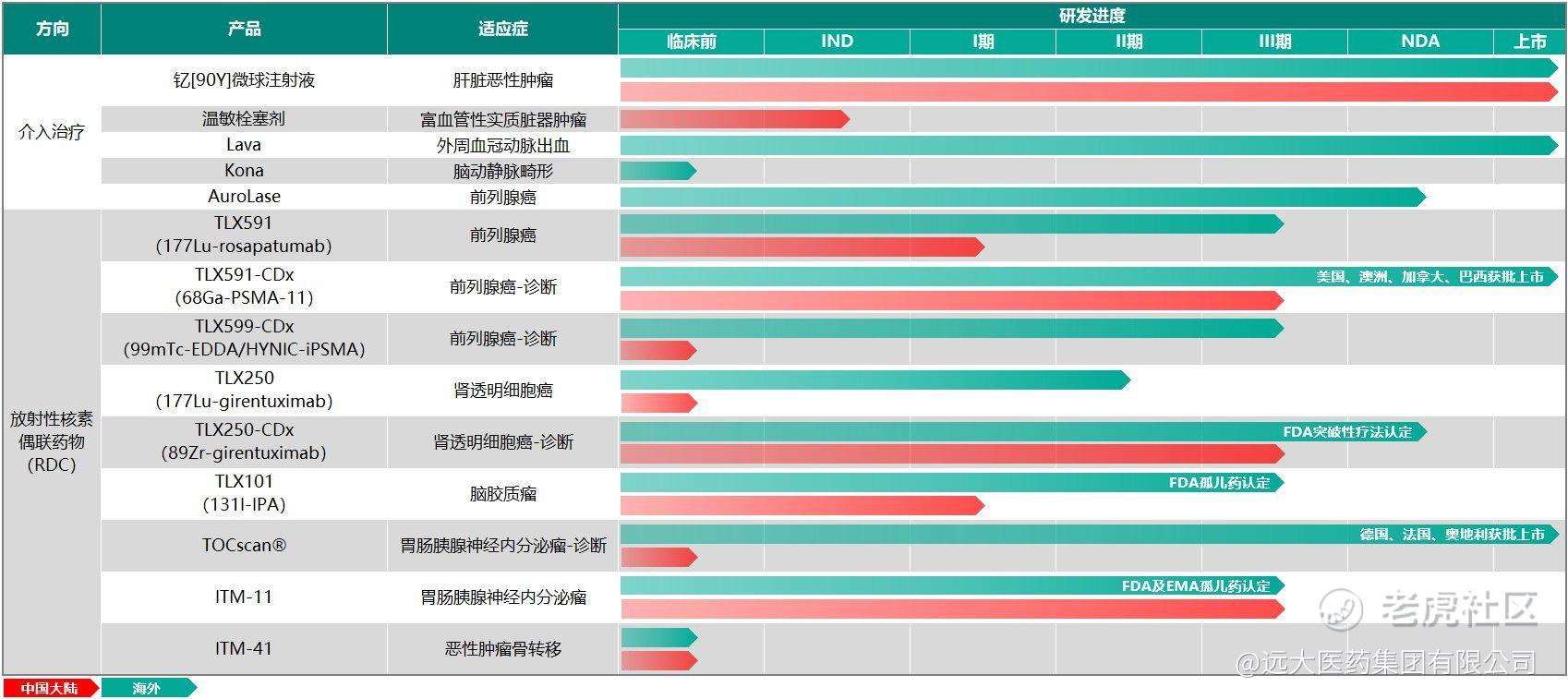
核药抗肿瘤诊疗板块是本集团的重点布局的领域之一。围绕肿瘤诊疗一体化的治疗理念,本集团核药抗肿瘤诊疗板块目前已储备14款创新产品,其中9款为RDC创新药,涵盖68Ga、177Lu、131I、90Y、89Zr、99mTc在内的6种放射性核素,覆盖了肝癌、前列腺癌、脑癌等在内的7个癌种;在产品种类方面,涵盖诊断和治疗两类核素药物,为患者提供多适应症治疗选择、多手段且诊疗一体化的全球领先的抗肿瘤方案。
目前,本集团在核药抗肿瘤诊疗板已有4款 RDC创新药获批开展临床研究,其中3款已进入III期临床阶段,包括诊断前列腺癌的产品TLX591-CDx、诊断透明细胞肾细胞癌产品 TLX250-CDx,以及治疗GEP-NETs的产品ITM-11。截至目前,本集团是进入中国III期临床研究中诊断和治疗类RDC创新药总计储备最多的企业,也是全球范围内在核药抗肿瘤领域拥有最丰富产品管线和诊疗一体化布局的创新药企之一。
关于本集团核药抗肿瘤诊疗平台:
核药抗肿瘤诊疗平台是本集团在抗肿瘤领域重点打造的高端技术平台,目前本集团已实现了研发、生产、销售、监管资质等多个环节的全方位布局,建立了完整的产业链。本集团联合Sirtex Medical Pty Limited并与Telix Pharmaceutical Limited (ASX: TLX)和ITM Isotope Technologies Munich SE合作,搭建了具有国际化一流水平的肿瘤介入研发平台和RDC药物研发平台,已拥有近 600名员工,硕士和博士人员占比约30%,是本集团全球化程度最高的板块之一。同时,本集团与山东大学联合成立了远大医药-山东大学放射药物研究院,借助山东大学实验核医学研究所在放射性核素研究的基础共同进行RDC药物的研发。
本集团正在有序推进甲级资质核素生产平台的建设。未来,本集团将持续加强核药抗肿瘤诊疗板块的研发和投入,丰富和完善产品管线及产业布局,形成以易甘泰®为核心的核药抗肿瘤诊疗产品集群,持续夯实本集团在全球核药抗肿瘤诊疗领域领军企业地位。
远大医药集团有限公司董事会表示:“本集团一直高度重视创新产品和先进技术的研发,未来将持续加大对全球创新产品和先进技术的投入,丰富和完善产品管线及产业布局,坚持‘全球化运营布局,双循环经营发展’策略,充分发挥本集团的产业优势和研发实力,快速将科技创新产品落地上市,为全球患者提供更先进更多样的治疗方案。”
前瞻性声明:
本新闻稿中可能会包含某些前瞻性表述。这些表述本质上具有相当风险和不确定性。在使用"预期"、"相信"、"预测"、"期望"、"打算"及其他类似词语进行表述时,凡与本集团有关的,均属于前瞻性表述。本集团并无义务不断地更新这些预测性陈述。
这些前瞻性表述是基于本集团管理层在做出表述时对未来事务的现有看法、假设、期望、估计、预测和理解。这些表述并非对未来发展的保证,会受到风险、不确性及其他因素的影响,有些是超出本集团的控制范围,难以预计。因此,受我们的业务、竞争环境、政治、经济、法律和社会情况的未来变化及发展的影响,实际结果可能会与前瞻性表述所含资料有较大差别。
本集团、本集团董事及雇员代理概不承担(1)更正或更新本网站所载前瞻性表述的任何义务;及(2)若因任何前瞻性表述不能实现或变成不正确而引致的任何责任。
免责声明:上述内容仅代表发帖人个人观点,不构成本平台的任何投资建议。