谁将在**疫苗比赛中领先?
$辉瑞(PFE)$$Moderna, Inc.(MRNA)$$阿斯利康(AZN)$
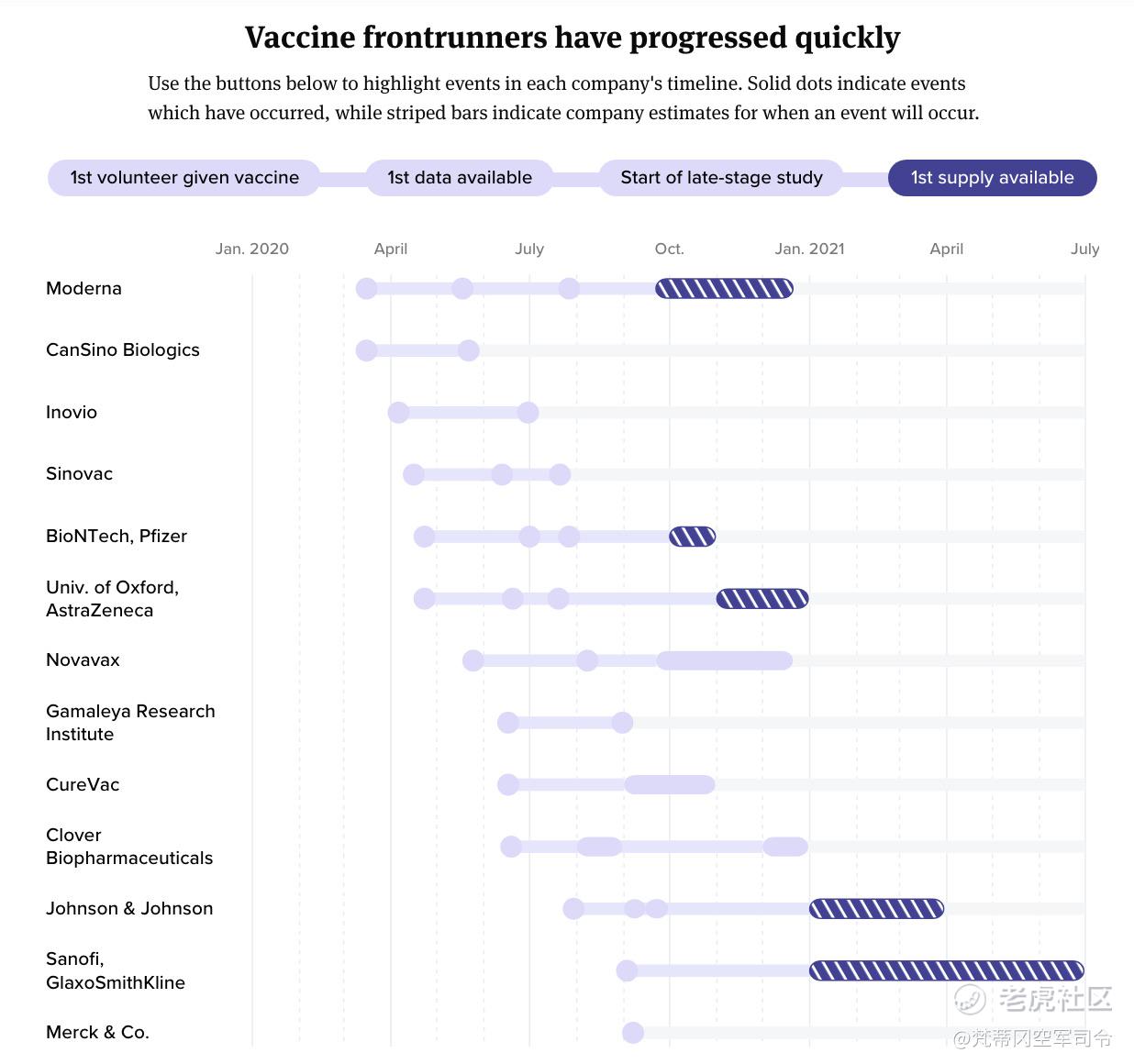
PFE / BNTX,MRNA和AZN / Oxford是排在前面的三个名称。
PFE / BNTX的剂量和试验设计使其具有优于MRNA的优势。
AZN仍然是一匹黑马,但是美国前的研究有不同的方案,美国的研究才刚刚开始。
BioNTech SE(BNTX)和辉瑞(PFE),Moderna(MRNA),阿斯利康(AZN)和牛津在美国批准**疫苗的竞争中处于领先地位。 我认为PFE / BNTX可能是第一个报告30,000名患者的美国试验结果的药物,这是FDA为保证紧急使用授权而要求的最小试验规模。 尽管如此,还是有必要对潜在的时间表和进度进行研究。
为什么PFE / BNTX会击败MRNA?
基于早期临床研究的结果,选择了PFE / BNTX的BNT162b2,这是一种编码“优化的SARS-CoV-2全长刺突糖蛋白”的RNA疫苗。 BNT162b1仍将由BNTX和复星医药在中国进行测试。 BNT162b2的PFE / BNTX 2/3期研究包括两次剂量,相隔21天。 PFE和BNTX于7月27日宣布开始这项研究,该研究最多可容纳30,000名参与者,其中包括“预计严重传播SARS-CoV-2的地区”。 在这样的区域中观察是有价值的,因为更高的事件发生率(占正在开发**的事件的比例)将有助于检测安慰剂和BNT162b2之间的差异。
到8月20日,即启动三周三天后,PFE披露它已经招募了11,000名参与者参加了30,000名参与者的研究。 已经在进行第二次给药(这是有道理的,因为第二次给药发生在21天时)。 尽管在8月20日新闻发布之时已经迅速报名,但仍在土耳其,德国和南非开设了新的试验场。 到8月26日,PFE科学家报告说,该研究现已被纳入50%以上的参与者(> 15,000名参与者)。 如果2/3期研究成功,PFE / BNTX计划在10月提交批准。 PFE在第二次注射后仅7天就开始研究**病例,以比较对照和疫苗。
现在,让我们看一下MRNA。 MRNA于7月27日宣布进行了30,000名参与者的mRNA-1273的3期COVE研究。到8月21日,MRNA招募了13,194名参与者。 根据8月18日的CNN报道,MRNA的试验入组显然在三周内达到了8,374,这是从8月18日到8月21日的入学率的相当大的提高,除非8,374的入选率是在第三周的早些时候而不是在结束时 第三周。 不幸的是,CNN的文章指出,人们担心MRNA的注册人数不足。
根据获得的数据,尽管黑人和拉丁裔占全国Covid-19病例的50%以上,但到目前为止,他们仅占全国首次测试冠状病毒疫苗的大规模临床试验参与者的15%。 来自政府官员的CNN。
伊丽莎白·科恩(Elizabeth Cohen)的CNN文章,2020年8月18日。
随着MRNA的8月21日更新,MRNA试验中的少数族裔详细信息也随之更新。
截至8月21日,星期五,黑人或非裔美国人,拉丁裔,美洲印第安人和阿拉斯加土著居民约占第三阶段研究所有参与者的18%。
CNN的文章讨论了COVE研究必须减慢招生速度以确保招募更多少数民族的可能性。 因此,MRNA有落后于PFE / BNTX的风险。
8月28日发生了类似的更新,该公司指出现在的入学人数为17,458。 看起来MRNA已成功增加了少数族裔的比例。
当我们考虑MRNA的COVE研究的试验设计时,我们发现相对于PFE / BNTX研究的设计,它会延迟报告结果。 COVE研究在第1天和第29天给患者剂量,并观察第二剂之后14天及以后的**发生情况。 由于PFE在第1天和第21天为患者给药,并且从第7天起及第二次注射后开始观察**病例,因此PFE比MRNA具有两周的优势。 那些追踪MRNA研究入学率的人指出,入学每周大约有4,000名参与者,并且应该在9月的第三周完成。 鉴于PFE招募患者的比率相似,因此两周的优势似乎足以让PFE / BNTX在MRNA之前报告结果。
AZN /牛津呢
对于AZN /牛津大学,曾经有过讨论,如果该公司的10,000名患者在英国的研究证明其疫苗(AZD1222)有效,尽管FDA已要求至少30,000人进行研究,但可以紧急使用授权。 由于AZN强烈反对这些建议,因此尚不清楚名称是否真的是领先者,这使我回到了PFE和BioNTech。 例如,8月31日,AZN宣布计划招募50,000多名参与者,其中包括美国的30,000名。 但是,有可能在宣布30,000名美国患者的数据之前先宣布其他20,000名参与者的数据。
为了清楚起见,尽管有9万人参加了该研究,但该研究已于9月1日报道,目前已将30000名患者的美国研究列为“尚未招募”。 该试验给患者剂量两次,间隔四个星期,并在第二次剂量后15天及以后观察**病例。
关于美国以外的研究,英国的研究正在20个地点进行招募,目标招募对象为12,330名患者。 该研究确实涉及在研究的某些部分中间隔四到六周重复给药候选**疫苗,但并未具体说明何时进行**病例与对照比较。 这项英国试验还包括一个活跃的比较器组,该组包含两剂脑膜炎球菌疫苗,相隔4-12周。 这可能会大大减慢从试验中读出的数据。 此外,对美国前研究的比较显示了协议中的某些不一致之处。 例如,英国和南非试验中使用的第二剂剂量存在差异。 同时,在5,000名参与者中进行的巴西试验仅使用一次剂量。
值得一提的是AZN有1,090名患者的1/2期临床研究可以证明疗效,但也许对该功效的置信区间会比FDA想要的要大(下限跨越30%的功效; FDA想要50 功效百分比,下限高于30%)。 那时的试验尚不足以在世界任何地方批准,但可能表明开发有效的**疫苗是可能的。
结论
就报告结果的时间表而言,PFE / BNTX似乎比MRNA提前了约两周,这是由于给药时间表(21天vs. 29天)和终点时间表(7天vs. 14天)更加严格。 两项试验的入组率似乎都非常相似。 AZN / Oxford似乎承诺不走捷径,结果在美国遥不可及。 AZN在美国以外的研究结果的发布时间似乎很难确定,在这种情况下,投资者将需要等待更新。
精彩评论