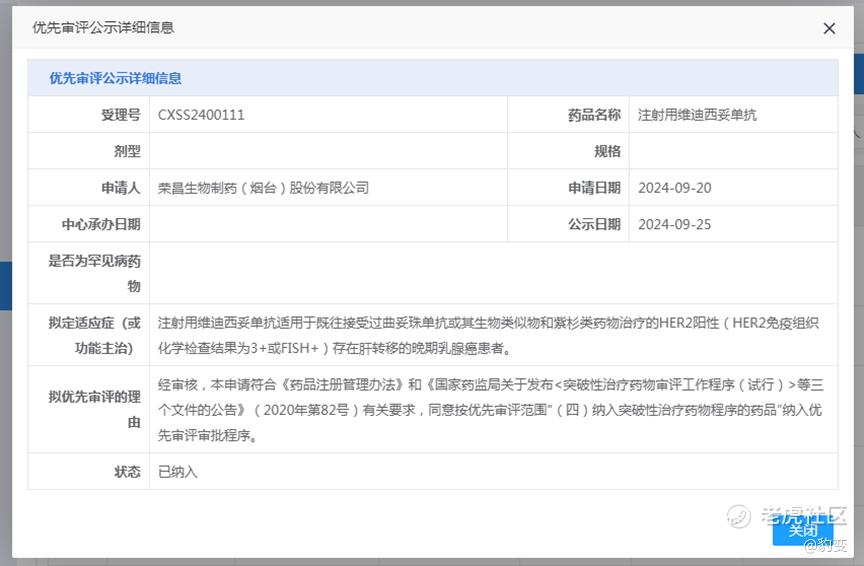
10月15日,荣昌生物宣布,其原创抗体偶联药物(ADC)维迪西妥单抗(RC48,爱地希®)一项新适应症的上市申请,已获国家药品监督管理局药品审评中心(CDE)受理,同时CDE同意按优先审评范围 “纳入突破性治疗药物程序的药品”纳入优先审评审批程序,适应症为:用于既往接受过曲妥珠单抗或其生物类似物和紫杉类药物治疗的HER2 阳性(HER2免疫组织化学检查结果为3+或FISH+)存在肝转移的晚期乳腺癌患者。
此前,该项目已于2021年6月获得CDE授予的突破性疗法认定。优先审评和突破性疗法认定是药品监管中的重要加速审批路径。优先审评旨在加快具有明显临床优势的新药的上市进程,通常用于治疗严重危及生命或严重影响生活质量的疾病。突破性疗法认定则是对在临床试验中显示出显著疗效的新药进行快速审批,以满足未被满足的医疗需求。获得这些认定意味着药物在临床试验中展现了显著的治疗效果和安全性,具有较高的临床应用价值。
本次新药上市申请基于一项在中国开展的、开放、平行对照、多中心的Ⅲ期临床研究(RC48-C006,NCT03500380),旨在评价注射用维迪西妥单抗对比拉帕替尼联合卡培他滨用于治疗HER2阳性晚期乳腺癌患者的有效性及安全性。研究显示,与拉帕替尼联合卡培他滨相比,维迪西妥单抗可显著延长患者的无进展生存期 (PFS)。此项研究的详细数据预计将在12月举行的圣安东尼奥乳腺癌会议(SABCS)上公布。
乳腺癌是全球排名第2位的常见恶性肿瘤。根据全球癌症流行病学报告,2022年全球乳腺癌新发病例约230.9万例,居所有癌种首位。在中国,2022年乳腺癌新发病例约35.7万例,死亡病例约为7.5万例,面临严峻的疾病负担。尽管现有治疗手段多样,但乳腺癌治疗仍面临一些瓶颈,如药物耐药性、治疗副作用、特异性治疗方案的缺乏等。特别是对于存在肝转移的晚期乳腺癌患者,治疗选择有限,预后较差,维迪西妥单抗的上市申请获受理,有望在不久的将来为这些患者带来新的治疗希望。在乳腺癌领域,除了HER2阳性人群外,维迪西妥单抗针对HER2低表达乳腺癌人群的临床研究正处于Ⅲ期临床研究中(NCT04400695)。
目前,维迪西妥单抗已有两个适应症在国内获批上市,分别适用于至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌患者、既往接受过含铂化疗且HER2过表达局部晚期或转移性尿路上皮癌患者,并被纳入国家医保目录。除已获批适应症外,荣昌生物正在拓展胃癌、尿路上皮癌等适应症的前线疗法,Ⅲ期临床试验正在开展中。
精彩评论