提到乐普生物,最吸引资本关注的是它在PD-1和ADC两大领域的布局。
众所周知,PD-1是驱动中国头部创新药企崛起的核心动能,作为后来者的乐普生物,虽然PD-1产品普特利单抗的市场占有率较低,但依然成功在PD-1红海占领一席之地。
如今ADC已经接过了PD-1的热棒,作为国内拥有ADC管线最多的企业,乐普生物的ADC研发进展值得期待,近期,终于迎来重磅喜讯。
1
首款ADC即将撞线
9月27日,乐普生物宣布旗下MRG003用于二线或以上治疗鼻咽癌的上市申请获得NMPA受理,同时,此次上市申请也被纳入优先审评,有望加速获批上市;此前,FDA 也曾授予MRG003 孤儿药资格、快速通道资格、突破性疗法认定,用于治疗复发性或转移性鼻咽癌。
MRG003进行了差异化设计,由抗EGFR人源化单抗JMT101与细胞毒药物甲基澳瑞他汀E(MMAE)通过可裂解的连接子VC-PAB偶联而成。JMT101是一种重组人源化抗表皮生长因子受体单克隆抗体,体外研究显示JMT101与人EGFR的亲和力约为西妥昔单抗的7倍;JMT101与西妥昔单抗具有相似的抗体依赖性细胞介导的细胞毒作用(ADCC)和补体依赖的细胞毒作用(CDC)效应。
根据去年ESMO会议上公布的MRG003治疗鼻咽癌IIa期临床最新数据,61例鼻咽癌患者,30例接受2.0mg/kg MRG003治疗,31例接受2.3mg/kg MRG003治疗。截至2023年3月15日,在先前经PD-(L)1及含铂化疗治疗、可评估疗效的57例鼻咽癌患者中,ORR为47.4%,DCR为79.0%。其中2.3mg/kg剂量组29例可评估疗效,ORR为55.2%,DCR为86.2%。
ADC为乐普生物重点布局的方向,旗下共有7款ADC新药处于临床阶段,MRG003不仅是乐普生物进展最快的ADC产品,也是全球范围内进展最快的EGFR ADC药物,MRG003的申报上市意味着乐普生物的ADC管线即将进入收获期。
2
第二增长引擎出现
2018年,乐普生物通过快速收购完成管线的搭建,四年的时间,实现IPO,又于2022年11月在火热的PD-1市场推出第一款商业化产品普特利单抗,并依靠普特利单抗在上市首个完整年度(2023年)的1.01亿元收入,完美实现的亏损的大幅收窄。
根据2024H1最新半年报数据,乐普生物总营收1.33亿元,主要收入依然来自PD-1普特利单抗,上半年卖出9480万元,较2023年同期增长115.4%,虽然目前普特利单抗正处在快速爬坡放量阶段,但是寻找普特利单抗之外的第二大业绩增长引擎也是乐普生物的必修课。
作为即将撞线的MRG003,确实有不错的潜力,主要因为首发适应症复发性或转移性鼻咽癌的市场前景及其本身优秀的临床数据。
WHO 2020年公布的数据显示,全球范围内新增确诊鼻咽癌患者133354例,死亡80008例,其中中国新增诊断62444例鼻咽癌患者,占全球46.8%。我国是鼻咽癌新发患者最多的国家。
目前国内一、二线鼻咽癌存量患者超过20万人,若按每年新增鼻咽癌患者2.3万计算(5.1万-2.8万),3年后鼻咽癌患者存量总人数将超27万。我国约80%鼻咽癌患者EGFR呈阳性,MRG003最适配的潜在用药人群约21.6万人。假设MRG003 定价年费15万,MRG003渗透率峰值10%,那么MRG003潜在销售峰值将有32.4亿。而且鼻咽癌青壮年患者偏多,患者接受付费治疗的意愿更强烈,粗略预计MRG003鼻咽癌适应症实际销售峰值或在15亿-20亿之间。
另外,临床数据上,MRG003的表现十分亮眼,根据去年ESMO会议上公布的治疗鼻咽癌IIa期临床最新数据,MRG003的鼻咽癌适应症相关2.0mg/kg和2.3mg/kg两个剂量组的平均ORR达到50%以上。当前临床上鼻咽癌的前线治疗以化疗、免疫治疗为主,ORR一般在20-30%之间;现行CSCO指南一线鼻咽癌I级推荐方案是特瑞普利单抗和卡瑞丽珠单抗,其中特瑞普利单抗治疗后线鼻咽癌ORR 20.5%,卡瑞利珠单抗ORR 28.2%,ORR也不及30%。
相比之下,MRG003单药有显著优势,不仅如此,MRG003联合PD-1(普特利单抗)治疗的有效性也会高于目前指南一线推荐的PD-1+化疗的方案,有望代替PD-1联合化疗用于一线鼻咽癌治疗。
与此同时,MRG003头颈鳞癌适应症也正在开展III期临床试验。从乐普生物公布的临床研究数据来看,头颈鳞癌适应症的MRG003-004研究中,2.3mg/kg剂量组的ORR和DCR分别为43%和86%,ORR、持续缓解时间也较为突出,目前国内暂时没有治疗头颈鳞癌的ADC药物,MRG003头颈鳞癌适应症同样具备较大的商业化潜力。
另一方面,从靶点竞争格局上看,除了MRG003,EGFR ADC赛道进展最快的只有石药集团的CPO301,已在国内进入Ⅲ期临床,不过首发适应症是针对非小细胞肺癌,其余的国内在研EGFR ADC多处于IND及临床前,且研发方向多是非小细胞肺癌适应症,与MRG003无直接竞争,也就是说,MRG003如若顺利获批上市,将获得较长的市场独占期。
总之,MRG003颇有出道即“王”的底气,是乐普生物妥妥的第二业绩增长引擎。
3
其他ADC候选药物后劲十足
ADC作为新一代的药物,2019年后,如雨后春笋般接连获批上市,2021年荣昌生物爱地希的获批上市标志着国产ADC创新药开发也迎来里程碑,之后中国企业在ADC赛道的研发热火朝天地推进着。
截至目前,全球获批上市的15款ADC药物,共涉及11个靶点,包括CD33、CD30、HER2、CD22、CD79b、Nectin-4、BCMA、EGFR、CD19、Tissue Factor和FRα。在研方面,当下的主流靶点有实体瘤领域的热门靶点HER2和Trop-2,还有一些新兴靶点如Claudin 18.2、EGFR、Nectin-4、HER3、TF等。
除了MRG003,乐普生物管线中的其他6款ADC产品,不仅针对当下ADC的主流靶点,其差异化设计也颇有看点。
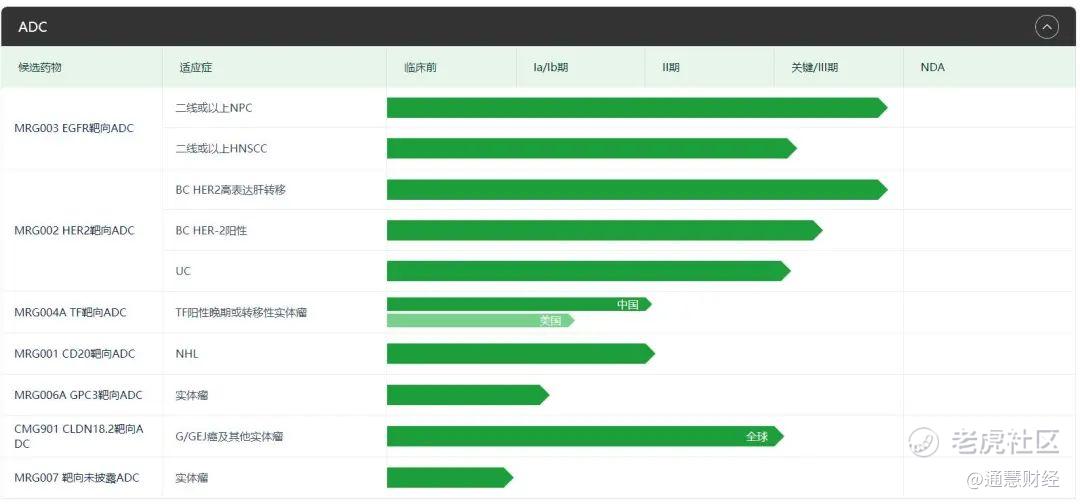
乐普生物ADC产品,图源:官网
MRG002是一款HER2靶向ADC候选物,目前已进入临床试验Ⅲ期,其单药差异化布局的适应症为存在肝转移的HER2阳性乳腺癌,存在严重未满足的临床需求,除了单药,乐普生物还探索MRG002+普特利单抗治疗HER2表达实体瘤的研究,目前进入II期试验。适应症的差异化布局以及与联合PD-1用药的探索,都有意避开HER2 ADC在国内的内卷,为后期创造更多的突围空间。
CMG901由人源化Claudin 18.2抗体通过可裂解连接子与单甲基auristatin E(MMAE)偶联而成,是潜在同类首创、靶向Claudin 18.2的ADC药物,也是首个在中美均取得临床试验申请批准的靶向Claudin 18.2 ADC。
CMG901治疗晚期胃癌/胃食管结合部腺癌的I期临床数据显示,3个剂量组中,所有受试者都接受过至少一线的标准治疗,74%受试者接受过PD-1/PD-L1治疗。可评估患者的客观缓解率33%,疾病控制率70%,初步证实了Claudin 18.2 ADC药物在Claudin 18.2阳性晚期胃癌的卓越疗效。去年CMG901启动治疗晚期/转移性胃及胃食管结合部腺癌的III期临床试验,是全球第二款启动III期临床的Claudin 18.2ADC。
此外,MRG004A(TF-ADC)是国内首款,进度全球第二的TF-ADC,正处于临床Ⅱ期;MRG001(CD20-ADC)全球进度领先,也处于Ⅱ期阶段。
4
结语
从3年亏损21亿到2023年亏损缩减96.8%,近几年乐普生物依靠PD-1及ADC一路稳扎稳打,在医药资寒冬下,自信从容向前。
当下一场属于乐普生物的ADC盛宴即将开席,之后扭亏为盈指日可待。
来源:贝壳社
精彩评论