两年前,作为乐普生物“创新第一站”的 PD-1 抗体普特利单抗获批,宣告乐普生物开始进入创新成果收获期。近日,乐普生物的一款靶向 表皮生长因子受体( EGFR ) 的抗体偶联药物维贝柯妥塔单抗( MRG003 )递交上市申请,用于二线治疗接受过化疗和 PD-(L)1 抑制剂治疗的复发或转移性鼻咽癌( NPC )患者。该申请已被国家药监局纳入优先审评,有望加快上市进度。
经过二十来年的探索,靶向EGFR的新药已上市超20款,但EGFR ADC的开发并不顺利,仅有Cetuximab saratolacan(商品名Akalux,Rakuten Medical)一款产品在日本获批上市,其余国家的癌症患者无法受益。此外,Cetuximab saratolacan存在临床应用上的局限性。一方面,其有效载荷为光反应物质,需要通过激光系统进行局部激活,医护人员使用不便;另一方面,其适应症仅限于头颈癌,受益人群范围有待扩大。
维贝柯妥塔单抗此番申报上市,有望为国内癌症患者带来首个EGFR ADC药物,进一步满足国内抗肿瘤治疗的临床需求。作为首款申报上市的国产EGFR ADC,维贝柯妥塔单抗也再次向行业展示了乐普生物的研发实力。
运用ADC技术,解鼻咽癌之需
NPC是一种发生在鼻咽上皮内粘膜的鳞状细胞癌,其特征是远处转移。GLOBOCAN数据显示,2020年全球新发鼻咽癌患者13.3万例 [1] ,死亡患者8.0万例,其中我国新发NPC患者6.24万例,死亡患者3.48万例。从这个数据可以看出来,中国是NPC大国,NPC新发和死亡患者数几乎均占全球一半。
不过,NPC的临床需求远未满足。目前推荐的治疗手段以同步放化疗为主,EGFR单抗和PD-1单抗是患者在放化疗之外的治疗选择。然而,仍有20%-30%的患者会出现疾病复发,而这部分患者缺乏有效的二线和三线治疗选择。
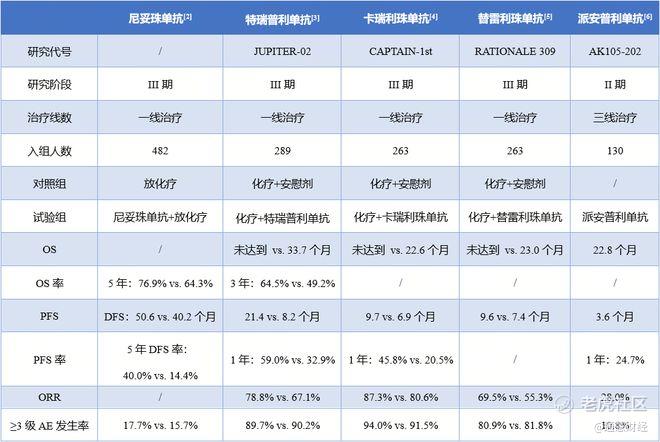
已获批的鼻咽癌靶向治疗药物疗效
注:1.数据由 医药魔方整理;2.DFS为无疾病生存期。
ADC在癌症后线治疗中的表现有目共睹,这种治疗手段也成为了满足NPC患者治疗需求的途径之一。EGFR是最早进入药物开发者视野的靶点,因其在NPC中呈高表达(≥80%),并且其靶点成药性已得到深度验证。
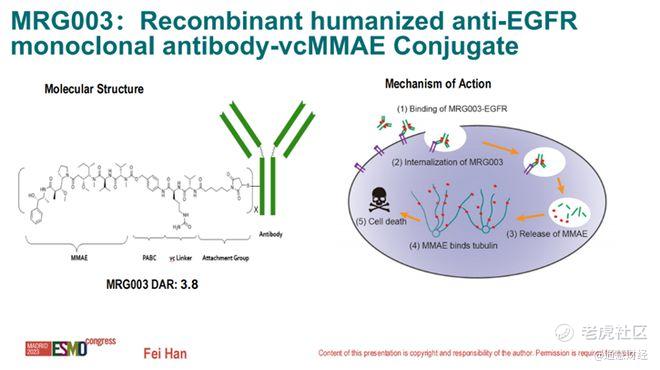
基于西妥昔单抗开发的Cetuximab saratolacan便应运而生,但这款药物仍存在不足之处且临床应用受限。为此,乐普生物开发了维贝柯妥塔单抗。
维贝柯妥塔单抗的抗体部分是经过全新设计的人源化EGFR单抗JMT101,其结合亲和力比西妥昔单抗提高了6-7倍,有助于其实现更高的靶向性。并且,可裂解linker缬氨酸-瓜氨酸(vc)和透膜性好的毒素甲基澳瑞他汀E(MMAE)的利用,也让维贝柯妥塔单抗具备了旁观者效应,可以实现范围更大的肿瘤杀伤效果。此外,维贝柯妥塔单抗也避免了光免疫疗法的使用不便问题。
来源:乐普生物ESMO 2023大会PPT
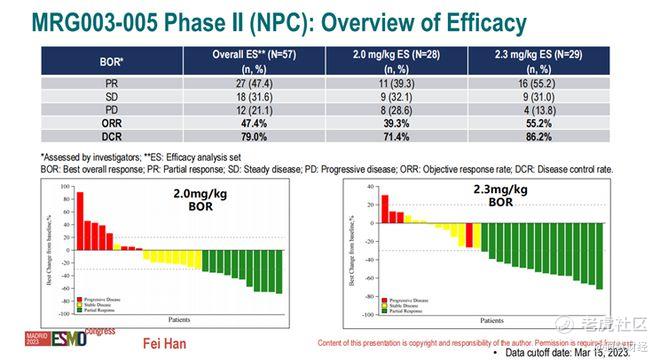
维贝柯妥塔单抗治疗NPC的疗效已在II期研究中得到初步验证 [7] 。结果显示,61例既往经铂类和/或PD-(L)1抑制剂治疗失败的NPC患者接受治疗后,2.0mg/kg队列(n=28)和2.3mg/kg队列(n=29)患者的客观缓解率(ORR)分别达到39.3%和55.2%,疾病控制率(DCR)分别达到71.4%和86.2%,中位缓解持续时间(DOR)均为6.8个月,中位无进展生存期(PFS)分别为7.3个月和尚未成熟。
来源:乐普生物ESMO 2023大会PPT
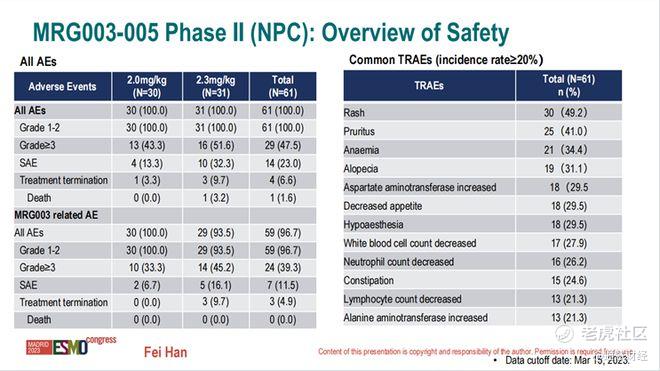
并且,维贝柯妥塔单抗具有良好的安全性,临床研究中报道的不良事件多为1-2级,3级及以上不良事件发生率较低。
来源:乐普生物ESMO 2023大会PPT
维贝柯妥塔单抗在NPC上的疗效和安全性也得到了CDE和FDA的认可,先后被授予突破性疗法资格(BTD)。此次上市申请被纳入优先审评也再次力证了维贝柯妥塔单抗的治疗潜力。
不过,维贝柯妥塔单抗的应用潜力并不止于NPC——EGFR在头颈癌、肺癌、结直肠癌等肿瘤中的表达率也不低,亦不止于单药治疗——乐普生物正在探索普特利单抗+维贝柯妥塔单抗的抗肿瘤效果。
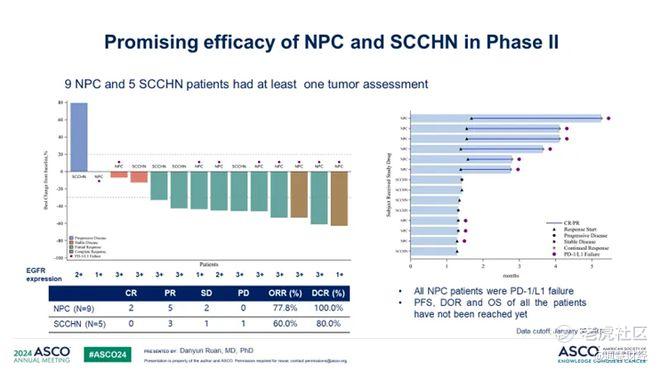
在今年的ASCO 2024大会上,乐普生物透露了普特利单抗+维贝柯妥塔单抗治疗NPC和头颈癌患者的I/II期研究数据 [8] 。结果显示,9例接受过PD-(L)1抑制剂和化疗治疗的NPC患者接受治疗后,ORR达到了77.8%(包括2例完全缓解和5例部分缓解),疾病控制率达到100%;5例未接受过系统治疗的头颈癌患者接受治疗后,有3例实现了部分缓解,ORR达到60%。
来源:乐普生物ASCO 2024大会PPT
这些数据表明,普特利单抗+维贝柯妥塔单抗的组合可能具备逆转PD-1耐药的潜力,并且有希望为头颈癌患者带来缓解率更高甚至是去化疗的治疗选择。头颈癌同样存在亟需突破的治疗困境,化疗占主导位置,而PD-(L)1药物带来的缓解率也不高。
ADC产品储备充足,自建“IO+ADC”模式
维贝柯妥塔单抗是乐普生物在ADC赛道交出的第一份答卷,其管线中还有其它不错的ADC产品储备。
乐普生物ADC管线(来源:乐普生物官网)
在CLDN18.2成药性初步确定后,ADC玩家涌入赛道,乐普生物是其中的鸣枪者。KYM Biosciences(乐普生物参股子公司)开发的CMG901(AZD0901)是全球范围内第一款进入临床阶段的CLDN18.2 ADC,在胃癌患者中展现I期疗效后即得到阿斯利康青睐。目前,CMG901的开发进度仍处于全球领先位置,其注册性III期临床正在进行中。
MRG004A是一款靶向Tissue Factor的ADC。Tissue Factor由血管壁相关细胞组成性表达,与血管生成、癌细胞的生长和转移等过程相关,因此也是有潜力的抗肿瘤靶点。MRG004A的治疗潜力已在早期研究中初步显露,Tissue Factor过表达的胰腺癌患者经其治疗后ORR高达80% [9] 。此外,MRG004A对三阴性乳腺癌和宫颈癌患者亦有不错的疗效。
靶向磷脂酰肌醇蛋白聚糖-3(GPC3)的MRG006A是乐普生物ADC技术平台进阶的第一个成果,其毒素已升级为拓扑异构酶I抑制剂,DAR值也达到了8。GPC3在肝癌中过表达而在正常组织中几乎不表达,因而是肝癌领域的新兴潜力治疗靶点,相关在研药物已达百款。MRG006A在今年7月启动了I/II期临床,是目前全球唯一一款处于临床阶段的GPC3 ADC。临床前研究显示,MRG006A具备有效的抗肿瘤活性和良好的安全性。
乐普生物的ADC管线是其对“IO+ADC”模式的前瞻性布局。“IO+ADC”模式的盛行有PD-(L)1抗体一份功劳,其去化疗潜力在维恩妥尤单抗+帕博利珠单抗的组合疗法中已有所体现。
在PD-(L)1抗体成为肿瘤治疗基石药物的当下,“PD-(L)1+ADC”模式发展得如火如荼。乐普生物在两年前推出了PD-1抗体普特利单抗,为“PD-(L)1+ADC”模式的探索打下基础。随着旗下ADC产品的稳步推进,乐普生物也已走上评估PD-1搭档ADC的抗肿瘤效果的新旅程。
总结
作为一家全面型的创新药企,乐普生物已形成丰富的产品管线,热门赛道和小众赛道均有涉足,例如PD-1、Tissue Factor、CLDN18.2、GPC3等,药物形式涵盖单抗、多抗、ADC、溶瘤病毒等。
乐普生物管线(来源:乐普生物2024年半年报)
乐普生物虽不是肿瘤领域的先行者,但对“IO+ADC”模式有着前瞻性的布局,在成立的六年间围绕“IO+ADC”构建了具有竞争力的管线。通过普特利单抗和维贝柯妥塔单抗两款产品的陆续NDA,乐普生物已完成探索“IO+ADC”模式的第一步,未来有望看到其在肿瘤治疗方面带来更多突破性成果。
来源:医药魔方



精彩评论