“华兴资本医疗与生命科技行业周报”定期发布,专注从资本角度解读一周数据,并提供最新行业观察。
医疗与生命科技是华兴资本多年来关注并深耕的领域,目前已为近200个融资及并购项目担任财务顾问。
医疗与生命科技行业创新不断涌现,已经发展成为最活跃的行业之一,华兴资本始终支持、陪伴这一领域创业企业成长,致力为行业带来理性专业的声音。
作者 | 华兴资本医疗与生命科技团队
关注华兴资本微信公众号(ID:iChinaRenaissance),后台点击“兴观点”-“行业观察”-“生命科技”,获取更多医疗与生命科技行业相关信息。
一然生物获新希望草根知本集团升望基金战略入股
近日, 一然生物获得新希望草根知本集团旗下专注为成长期企业赋能的升望基金战略入股,实现了益生菌与饲料端、养殖端、乳品产业领军企业的强强联合,双方将基于菌种的科研创新与产业化布局开展全方位的合作,发挥各自优势,以科学循证为基础、以营养健康为目标,推动我国自主知识产权的菌种科研与产业的高质量发展。
行业视角:
作为国内益生菌全端产业链头部企业,一然生物依托15年专注中国菌的科研探索,实现从菌种机理研究到工业化生产的技术成果转化,形成了菌种生物资源平台、功能循证平台、菌种产业化平台、益生菌应用创新平台、肠道菌群分析与生物营养创新等六大科研平台,形成了完整的自主研发体系。
楷拓生物完成近亿元新一轮融资
近日,楷拓生物(CATUG Biotechnology)宣布完成近亿元新一轮融资。本轮融资由倚锋资本、知壹投资领投,元禾控股、苏州园区科创基金跟投。本轮资金将用于楷拓生物海外业务和全流程CRDMO服务能力升级,夯实公司在核酸药物技术赛道上的核心竞争力。
行业视角:
楷拓生物从成立伊始就立足先进疗法领域,聚焦创新型核酸药物CRDMO服务,在疫情叠加行业周期的复杂市场环境下,得到多方投资者的大力支持,在近三年的时间内迅速位列核酸疗法领域CDMO第一梯队。
朗信生物宣布完成B+轮融资
2024年6月11日,基因治疗创新药企朗信生物宣布完成B+轮融资,本轮融资由上海生物医药基金领投,联和投资等股东跟投。本次融资将进一步加速朗信生物在基因治疗创新药物领域的研发和产业化进程。
行业视角:
朗信生物致力于基因治疗创新药物研发制造。公司成立至今,已经建成符合GMP法规的、可放大的生产AAV产品的平台工艺。
领博生物获得数千万元A+轮融资
2024年6月12日,领博生物科技(杭州)有限公司完成由杭州天士力新赛道股权投资合伙企业(有限合伙)投资的数千万元A+轮融资,这是领博生物继2023年底完成A轮后,短时间又完成的新一轮融资。本轮融资资金将主要用于现有产品临床推进和新适应症心脏搭桥人工血管的研发,加速多个临床前研究进展,推动领博生物再生医学领域的研发和创新。
行业视角:
领博生物秉承着“给技术以应用,给医疗以创新”的使命。致力于研发可替代、可修复人类组织与器官的组织工程人工器官及器官保护产品,矢志成为全球领先的再生医学研发制造企业。公司将继续秉承“因生命而创新”的愿景,充分利用这笔融资,加快产品研发、临床试验以及市场拓展的步伐,为全球患者提供更多、更好的组织工程人工器官及器官保护产品。
心光生物完成数千万元Pre-A轮融资
6月11日消息,上海心光有限责任公司宣布完成由海脉德创投,上海天祥实业和老股东合投的数千万Pre-A轮融资。
行业视角:
心光生物致力于推动透析技术的便利化,让全球超过三百万的尿毒症患者回归正常生活。2019年,心光生物作为首批入驻实验室JLABS@Shanghai的企业,孵化时间超过四年。期间,公司成功掌握了将酶用于血液净化领域的高壁垒核心技术,并围绕家庭透析,逐步形成了透析耗材、血管介入到便携式透析机的整体解决方案。
赛桥生物获近2亿元B轮融资
6月14日消息,赛桥方舟(深圳)生物科技有限公司近期完成近2亿元规模B轮融资,本轮融资由本草资本领投,弘盛资本跟投,老股东水木创投、腾业创投、昌发展和深圳天使母基金持续加注。本轮所募集资金,将加速新质生产设备的商业化进程。面向行业的长远发展目标和终局要求,赛桥生物致力于协助客户提升其产品的商业化竞争力,以期加速行业产业化的重要转折点。公司将以中国为基地,服务全球市场,为世界各地的客户提供卓越的解决方案。
行业视角:
赛桥生物主要从事细胞与基因治疗(CGT)行业上游的关键制造技术及成套核心装备的技术创新和国产化工作,实现CGT产业化装备的全封闭、自动化、数字化和柔性化。
瑞龙外科完成超3亿元B轮融资
手术机器人企业“瑞龙外科”近日完成3亿元人民币B轮融资,由无锡国联(旗下国联通宝、锡洲国际及扬州经开新兴产业基金)、渶策资本共同领投,King Star Med LP和老股东LongRiver江远投资跟投。本轮融资将加速模块化手术机器人产品的商业化及公司国际化。
行业视角:
瑞龙外科以响应临床需求、普及手术机器人多专科应用为目标,以提升多专科术式覆盖度、降低手术机器人学习及使用难度、提高性价比为创新重点。创立至今,已形成海山一®腔镜手术机器人系统、海山一®腔镜影像系统、海山一®手术器械等产品系列及100多项海内外专利申请。
晶泰科技在港交所主板挂牌上市
6月13日,晶泰科技(2228.HK)在香港交易所主板正式挂牌,这是首家依照18C规则在港交所主板上市的企业,发行价格每股5.28港元,净募集资金约 8.96 亿港元。晶泰科技此次 IPO 获得了 5 位领航资深独立投资者和8家全球知名机构基石投资者的支持,还吸引了近 80 家全球投资机构参与锚定投资,其中不乏来自欧美和中东的知名国际长线、医疗专项基金和对冲基金等,国际配售订单认购 2.13 倍。这也是过去两年规模5000万美元以上的发行中,唯一超 100 倍 HKPO 认购的上市公司。
行业视角:
晶泰科技是一家以量子物理、AI 与机器人驱动创新的研发平台企业,深耕算法与自动化的融合互通,在微观中改造世界,以智能化、自动化的新一代技术平台与解决方案,推动药物与材料科学产业的升级与高质量发展。公司已成为 AI for Science 领域的先锋,是学术和工业界创新研发的重要伙伴,获得 300 多家企业与科研客户的信赖与合作,并成功将业务拓展至农业技术、新化工、能源及化妆品等高附加值产业场景。
财政局:未经批准,禁止采购进口医疗设备
日前,河南鹤壁市财政局印发了《鹤壁市政府采购领域负面清单(2024版)》。这份文件明确了政府采购4个阶段中60种情形、210类表现形式的违法违规行为,其中多项违规采购进口设备、限制国产的行为也被纳入其中,严格禁止。
安进双特异性抗体再获FDA批准
百时美施贵宝口服酪氨酸激酶抑制剂Augtyro获FDA加速批准,用于治疗NTRK阳性实体瘤
安进“地舒单抗”在中国获批新适应症
礼来小分子抑制剂获FDA完全批准
君实生物抗PD-1单抗新适应症获批,用于小细胞肺癌一线治疗
诺华创新药妥瑞达®中国获批
多款医疗器械产品获批上市
安进双特异性抗体再获FDA批准
安进(Amgen)宣布,美国FDA批准其双特异性抗体疗法Blincyto(blinatumomab)用于治疗年龄一个月或以上、CD19阳性、费城染色体阴性B细胞前体急性淋巴细胞白血病(B-ALL)患者的巩固阶段治疗,无论患者的可测量残留病灶(measurable residual disease,MRD)状态如何。此次批准是Blincyto所获批的第三项适应症。
信息来源:药明康德
百时美施贵宝口服酪氨酸激酶抑制剂Augtyro获FDA加速批准,用于治疗NTRK阳性实体瘤
百时美施贵宝宣布,美国食品和药物管理局(FDA)已批准加速批准Augtyro™(repotrectinib)用于治疗12岁及以上患有神经营养性酪氨酸受体激酶(NTRK)基因融合的实体瘤的成人和儿科患者,这些实体瘤是局部晚期或转移性的,或者手术切除可能导致严重发病,并且在治疗后取得进展或没有令人满意的替代疗法。
信息来源:动脉网
安进“地舒单抗”在中国获批新适应症
6月13日,安进(Amgen)宣布其特异性靶向抗RANKL疗法地舒单抗注射液(商品名:普罗力)获得中国NMPA批准,用于治疗骨折高风险的糖皮质激素诱导的骨质疏松症(GIOP),可提升患者骨密度,降低骨折风险。至此,地舒单抗注射液已在中国获批3个适应症,其余两个适应症分别为治疗骨折高风险的绝经后妇女的骨质疏松症、骨折高风险的男性骨质疏松症。
信息来源:医药观澜
礼来小分子抑制剂获FDA完全批准
美国FDA宣布,将礼来公司开发的RET抑制剂Retevmo(selpercatinib)的加速批准转化为完全批准,用于治疗晚期或转移性RET融合阳性甲状腺癌成人和2岁以上儿童患者。这些患者需要接受全身性治疗,并且对放射性碘疗法产生耐药性。
信息来源:药明康德
君实生物抗PD-1单抗新适应症获批,用于小细胞肺癌一线治疗
6月12日,中国国家药监局(NMPA)官网最新公示,君实生物抗PD-1单抗药物特瑞普利单抗的一项新适应症申请已获得批准上市。根据君实生物早先新闻稿,该药本次获批的适应症为:联合依托泊苷和铂类用于广泛期小细胞肺癌一线治疗。
信息来源:医药观澜
诺华创新药妥瑞达®中国获批
2024年6月12日,诺华中国宣布,其治疗非小细胞肺癌药物妥瑞达®(盐酸卡马替尼片)获得中国国家药品监督管理局批准,用于未经系统治疗的携带间质上皮转化因子(MET)外显子14跳跃突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。妥瑞达® 的获批为中国的非小细胞肺癌患者带来新的治疗选择,帮助医生和患者更好地应对疾病挑战以及提升患者生活质量。
信息来源:诺华中国
多款医疗器械产品获批上市
飞利浦宣布其静脉支架Duo venous stent获FDA批准并完成首例商业化植入。Duo venous stent适用于治疗具有症状性静脉流出障碍的慢性静脉功能不全(CVI)患者。
信息来源:MedTF
近日,全新一代Precision放射治疗计划系统成功获批国家药品监督管理局颁发的医疗器械注册证(国械注许:20243210014),该系统通过数字化赋能医院放疗工作流,有效打破放射治疗计划壁垒,推进肿瘤的精准化、高效化、专业化治疗。
信息来源:器械之家
6月12日,国家药监局宣布近日批准了杭州诺生医疗科技有限公司生产的“一次性使用射频房间隔穿刺针”创新产品注册申请。
信息来源:器械之家
近日,上海微创心脉医疗科技(集团)股份有限公司的Hyperflex®球囊扩张导管(Φ32)获得日本药品和医疗器械管理局(PMDA)的注册批准。2022年3月,Hyperflex®球囊扩张导管(Φ40)首次在日本获批上市。
信息来源:思宇MedTech
近日,雅培(NYSE:ABT)宣布,其全球首个双腔无引线起搏器系统 Aveir DR 获得 CE 标志。此次雅培获批CE也意味着即将进军欧洲市场,进一步推广其Aveir DR 双腔无引线起搏器系统。
信息来源:医疗器械创新网
科伦博泰:默沙东启动第10项全球三期临床
现货型CAR-T疗法临床试验结果亮眼
强生小分子组合一线疗法积极研究结果公布
潜在“first-in-class” STAT3蛋白降解剂获临床概念验证
全球首款CRISPR基因编辑疗法长期疗效结果公布
罗氏双特异性抗体3期结果公布
生物技术公司UroGen宣布UGN-102治疗膀胱癌的3期试验12个月反应持续率为82.3%
Celldex:KIT抗体启动慢性自发性荨麻疹三期临床
科伦博泰:默沙东启动第10项全球三期临床
2024年6月14日,默沙东在Clinicaltrials.gov网站上注册了SKB264(MK-2870)的第10项全球三期临床,用于二线治疗复发性或转移性宫颈癌。
信息来源:医药笔记
现货型CAR-T疗法临床试验结果亮眼
Wugen公司公布其在研CD7靶向、现货型CAR-T疗法WU-CART-007在复发/难治性(R/R)T细胞急性淋巴细胞白血病/淋巴瘤(T-ALL/LBL)患者中的2期研究取得了积极结果。分析显示,有73%患者达成复合完全缓解率(CRc)的主要终点,总缓解率(ORR)达91%。详细数据公布于2024年欧洲血液学协会(EHA)大会中。
信息来源:药明康德
强生小分子组合一线疗法积极研究结果公布
强生(Johnson & Johnson)宣布了CAPTIVATE临床2期研究的最新结果,该研究评估了固定疗程(fixed-duration,FD)的Imbruvica(ibrutinib,伊布替尼)与venetoclax联合(I+V)用于初治慢性淋巴细胞白血病(CLL)患者的疗效。分析显示,所有接受治疗患者的5年总生存率高达96%。
信息来源:药明康德
潜在“first-in-class” STAT3蛋白降解剂获临床概念验证
Kymera Therapeutics公布其在研蛋白降解小分子药物KT-333临床1期试验的更新数据。分析显示,KT-333完成初步临床概念验证,在多种血液恶性肿瘤中展示了抗肿瘤活性,包含在两名经典霍奇金淋巴瘤(cHL)患者中达到完全缓解。
信息来源:药明康德
全球首款CRISPR基因编辑疗法长期疗效结果公布
Vertex Pharmaceuticals宣布其CRISPR/Cas9基因编辑疗法Casgevy(exagamglogene autotemcel,exa-cel)在全球临床试验中,用于治疗重度镰刀型细胞贫血病(SCD)或输血依赖性β地中海贫血(TDT)患者的最新长期数据。根据新闻稿,这是全世界首款获批上市的CRISPR基因编辑疗法。
信息来源:药明康德
罗氏双特异性抗体3期结果公布
罗氏(Roche)在欧洲血液学协会(EHA)会议上公布其3期试验STARGLO的详细结果。分析显示,与活性对照药物相较,使用其双特异性抗体Columvi(glofitamab)联合吉西他滨和奥沙利铂治疗的复发或难治性(R/R)弥漫性大B细胞淋巴瘤(DLBCL)患者,在总生存期(OS)、无进展生存期(PFS)和完全缓解(CR)率上皆表现出统计学显著且具临床意义的益处。
信息来源:药明康德
生物技术公司UroGen宣布UGN-102治疗膀胱癌的3期试验12个月反应持续率为82.3%
UroGen Pharma Ltd.(URGN)宣布,UGN-102治疗膀胱癌患者的Envision 3期临床试验的12个月反应期为82.3%。UroGen总裁兼首席执行官利兹·巴雷特(LizBarrett)说,UGN-102在多项试验中显示出强大的临床表现,最新结果显示,三个月完全缓解率为79.6%,12个月时DOR为82.3%,这增强了其成为FDA批准的首个治疗LG-IR-NMIBC的非手术选择的潜力。
信息来源:动脉网
Celldex:KIT抗体启动慢性自发性荨麻疹三期临床
2024年6月12日,Celldex Therapeutics在Clinicaltrials.gov网站上注册了Barzolvolimab治疗慢性自发性荨麻疹(CSU)的三期临床试验。
信息来源:医药笔记
亚盛医药与武田就第三代BCR-ABL抑制剂奥雷巴替尼全球许可签署独家选择权协议
亘喜生物与苏州生物医药产业园深化战略合作
小分子疗法研发商Biosplice宣布与诺和诺德在糖尿病领域开展合作
国产TL1A单抗出海
肿瘤新药研发商Calidi Biotherapeutics与SIGA Technologies合作,推进Calidi针对肺癌和转移性实体瘤的RTNova病毒疗法
亚盛医药与武田就第三代BCR-ABL抑制剂奥雷巴替尼全球许可签署独家选择权协议
亚盛医药(6855.HK)宣布与武田签署了一项独家选择权协议,就公司具有best-in-class潜力的第三代BCR-ABL酪氨酸激酶抑制剂(TKI)耐立克®(奥雷巴替尼)达成独家许可协议。一旦选择权被行使,武田将获得开发及商业化奥雷巴替尼的全球权利许可,惟中国大陆、中国香港特别行政区、中国澳门特别行政区、中国台湾等地区除外。
信息来源:亚盛医药
亘喜生物与苏州生物医药产业园深化战略合作
6月14日消息,阿斯利康(AstraZeneca)集团成员亘喜生物宣布与苏州生物医药产业园正式签署合作备忘录。根据协议,亘喜生物将深化与苏州生物医药产业园的战略合作,进一步扩展生产空间,提升细胞治疗药物产能,以保障后续开展更多临床研究的用药需求,进一步夯实阿斯利康细胞疗法领域的实力。此次扩增的生产设施占地面积约9000平米,整体项目将于今年年内动工,预计于2025年底前竣工。
信息来源:医药观澜
小分子疗法研发商Biosplice宣布与诺和诺德在糖尿病领域开展合作
Biosplice Therapeutics,Inc.是一家临床阶段的生物技术公司,开创了基于小分子抑制DYRK/CLK激酶的一流治疗方法,已与诺和诺德合作开发治疗糖尿病的候选药物。
信息来源:动脉网
国产TL1A单抗出海
6月13日,明济生物制药(北京)有限公司与艾伯维共同宣布签署一项开发FG-M701的许可协议。FG-M701是一种用于治疗炎症性肠病(IBD)的下一代TL1A抗体,目前正处于临床前开发阶段。根据协议条款,艾伯维将获得FG-M701在全球进行开发、生产和商业化的独家许可权。明济生物将获得1.5亿美元作为预付款和近期的里程碑付款,并有资格额外获得最高可达15.6亿美元的临床开发、监管注册和商业化的里程碑付款,以及最高可达净销售额低两位数比例的分级特许权使用费。(注:共计17亿美元,折合为人民币约123亿元)
信息来源:动脉网
肿瘤新药研发商Calidi Biotherapeutics与SIGA Technologies合作,推进Calidi针对肺癌和转移性实体瘤的RTNova病毒疗法
Calidi Biotherapeutics,Inc.(纽约证券交易所美国代码:CLDI或“Calidi”),一家开发新一代靶向抗肿瘤病毒疗法的临床阶段生物技术公司,宣布,它于2024年第一季度与SIGA Technologies(纳斯达克代码:SIGA)签订了合作协议,以支持Calidi系统性和靶向性RTNova(CLD-400)病毒治疗平台的开发,该平台有可能为所有肿瘤类型提供普遍治疗。
信息来源:动脉网
保荐人撤销保荐,云舟生物IPO终止
6月13日,上海证券交易所官网显示,云舟生物科技(广州)股份有限公司的保荐人海通证券申请撤销保荐,云舟生物科创板上市终止。
信息来源:医药魔方Invest
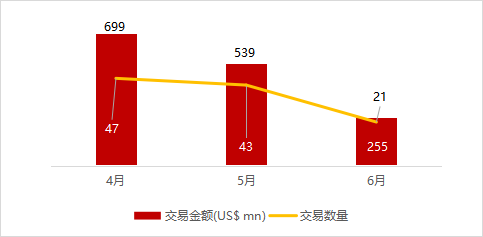
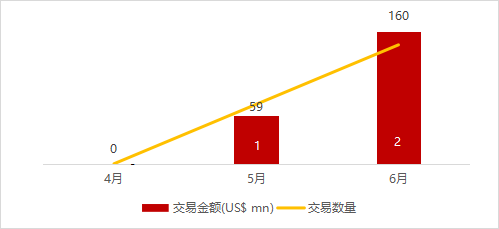
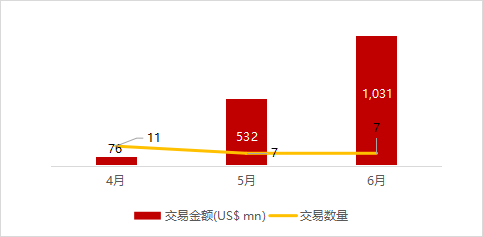
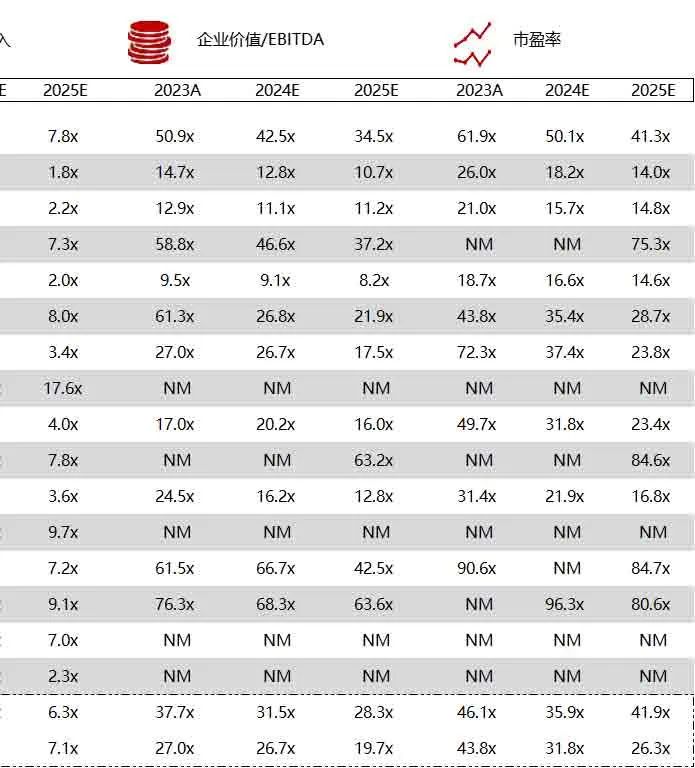
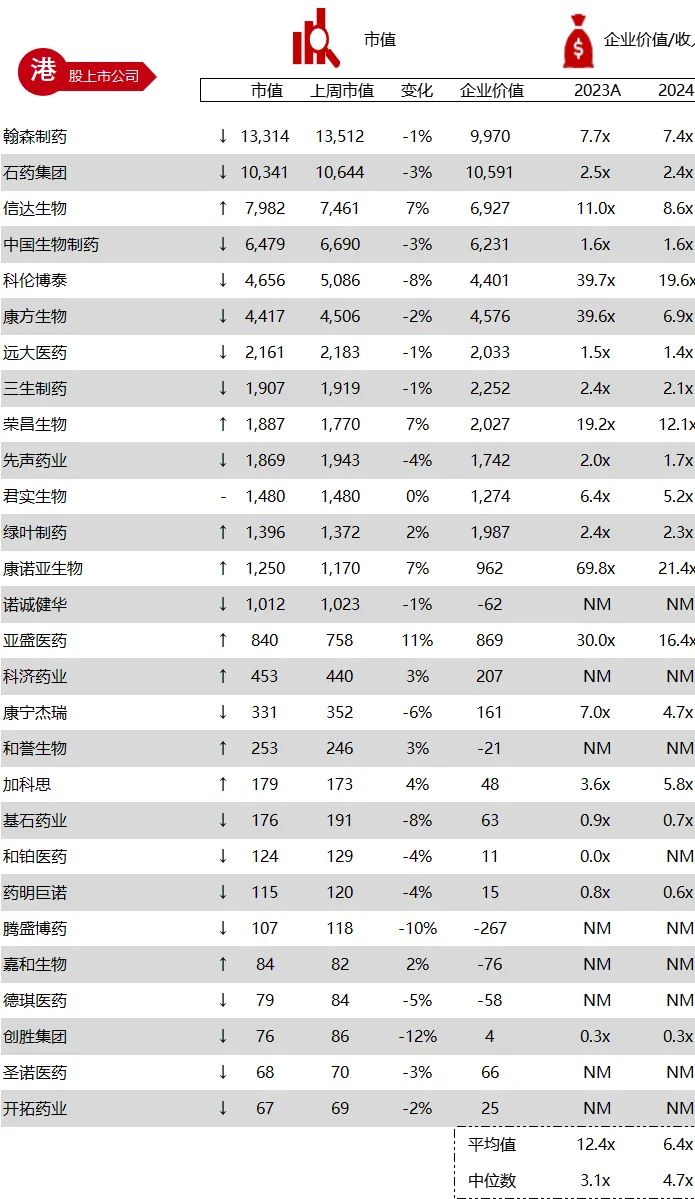
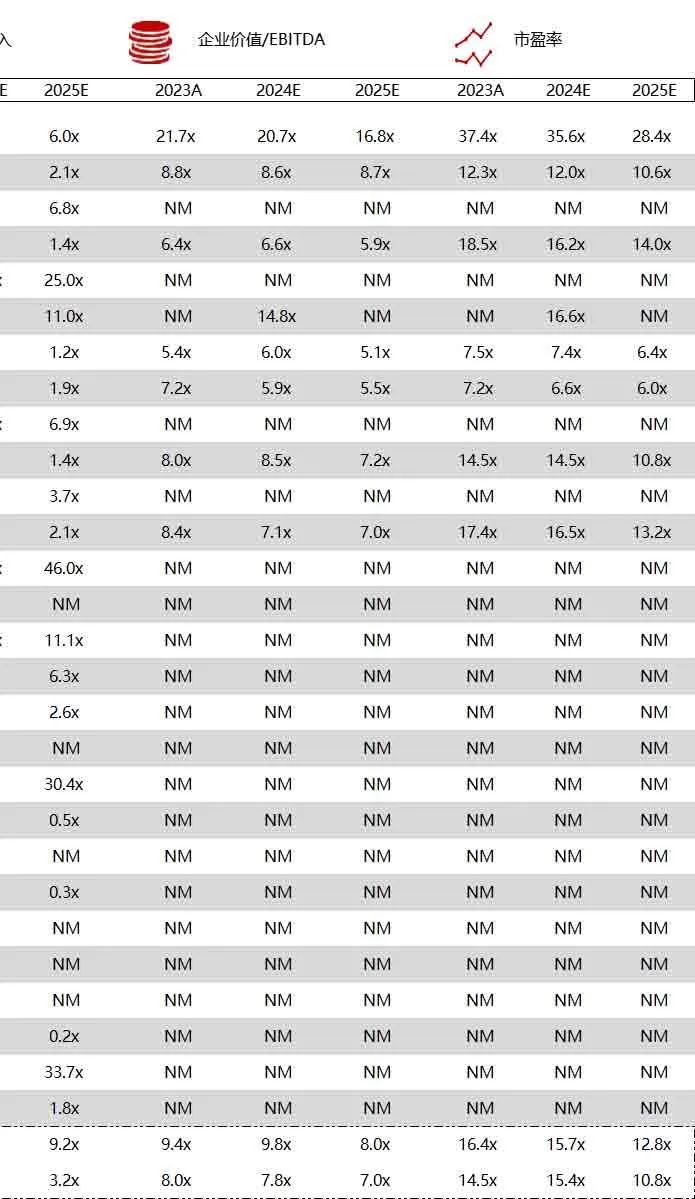
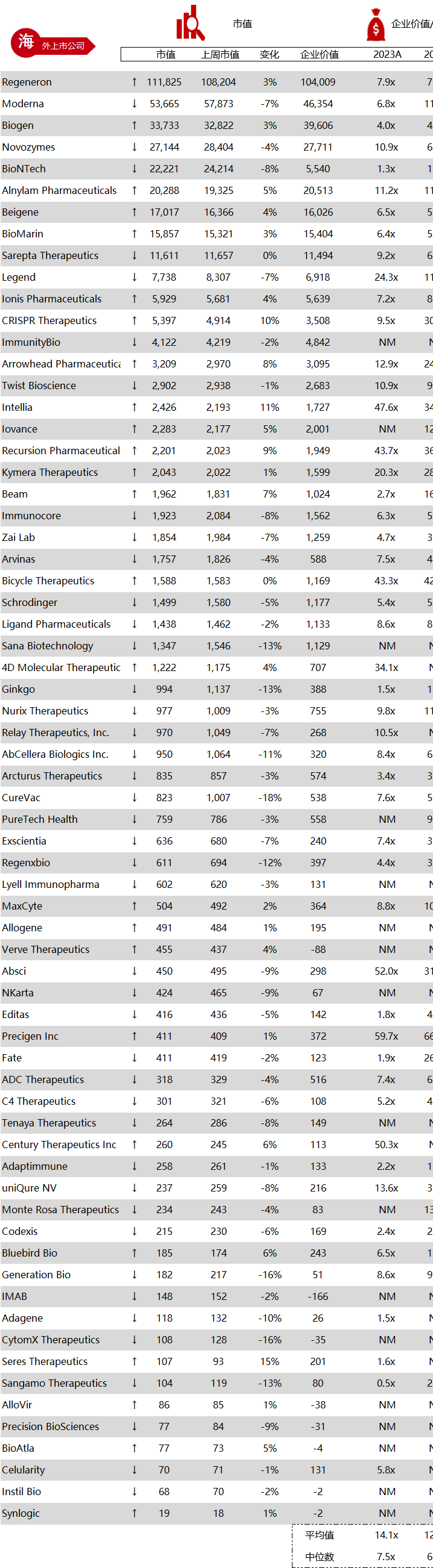
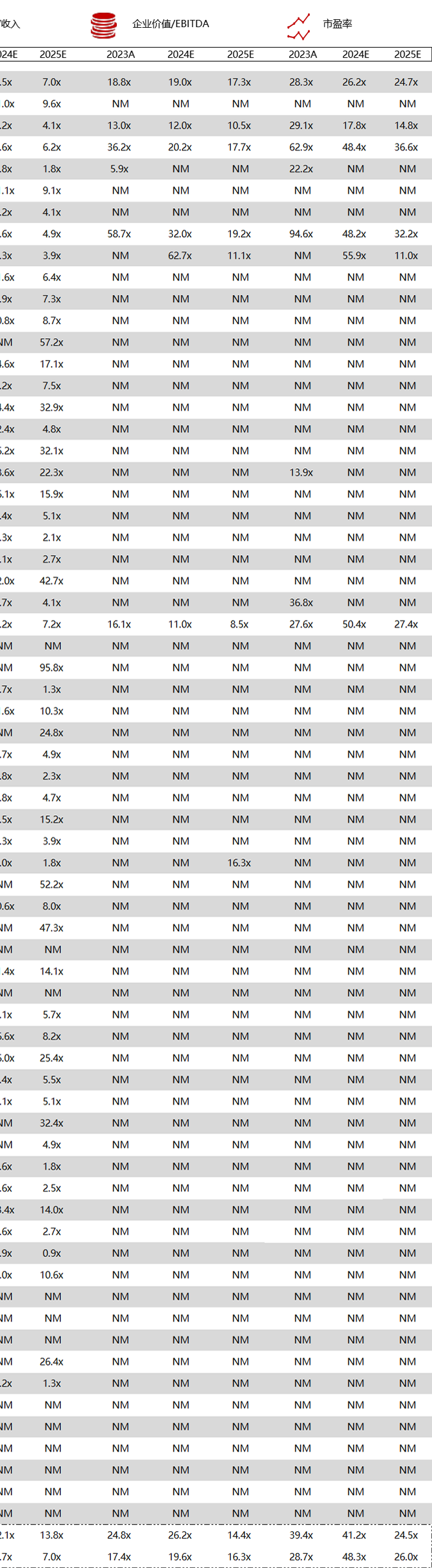
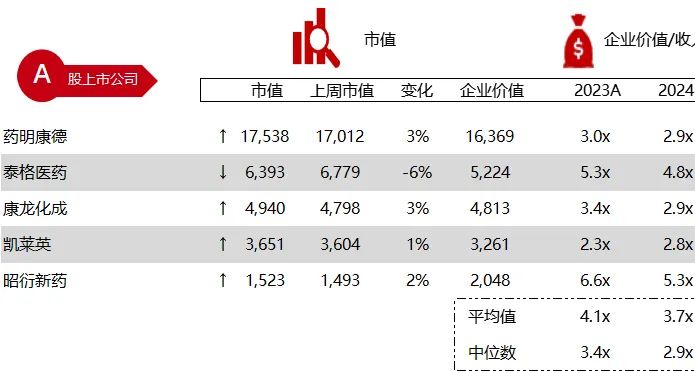
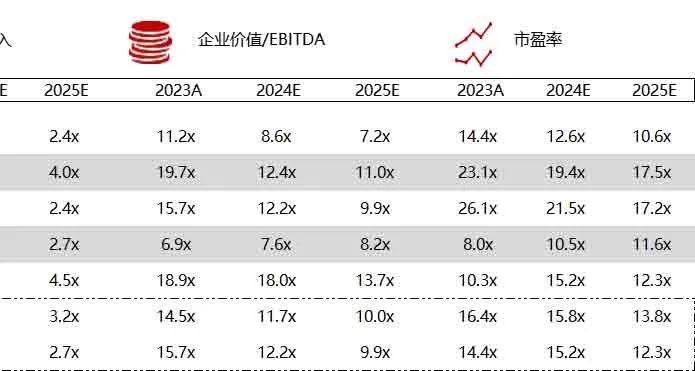
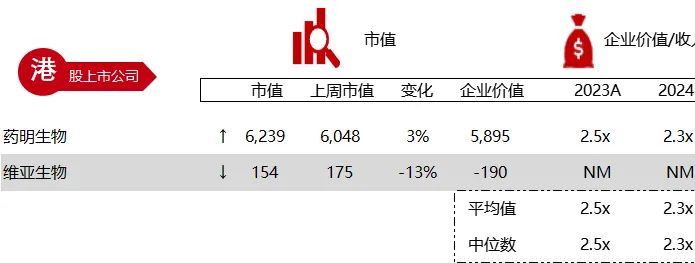
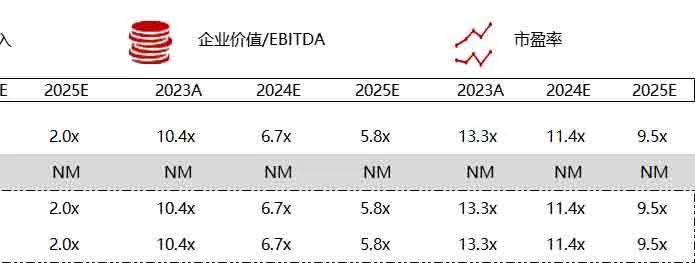
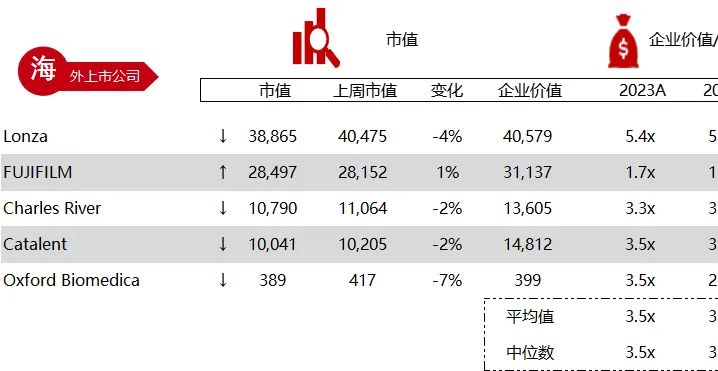
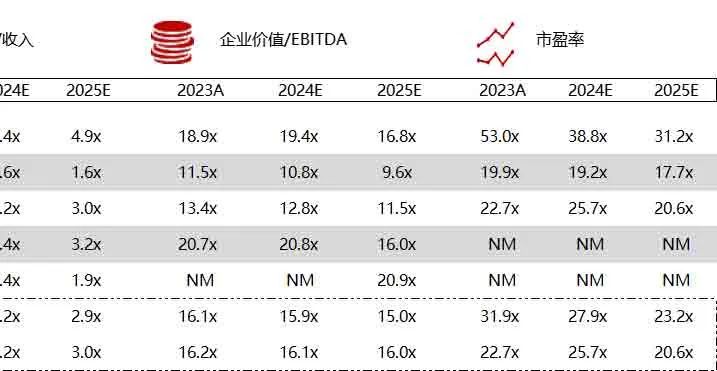
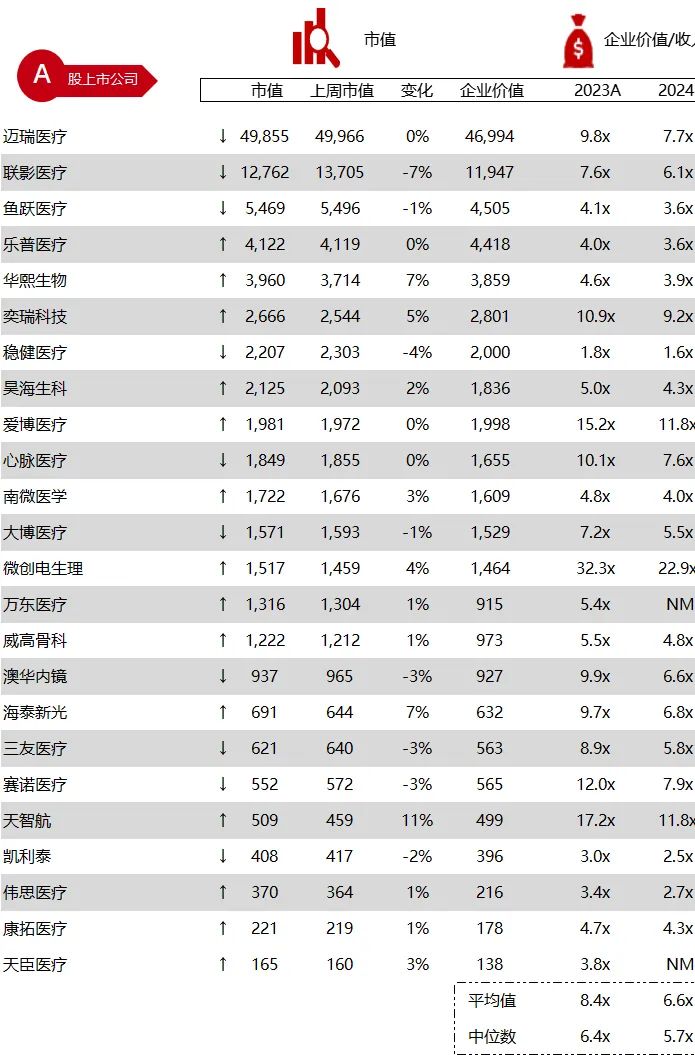
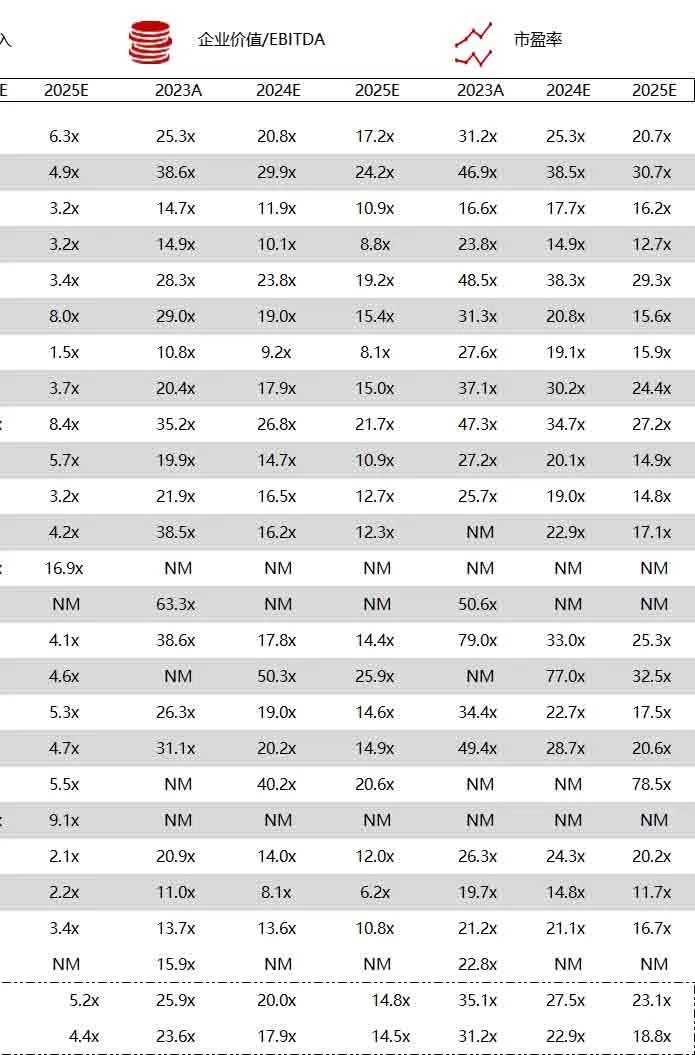
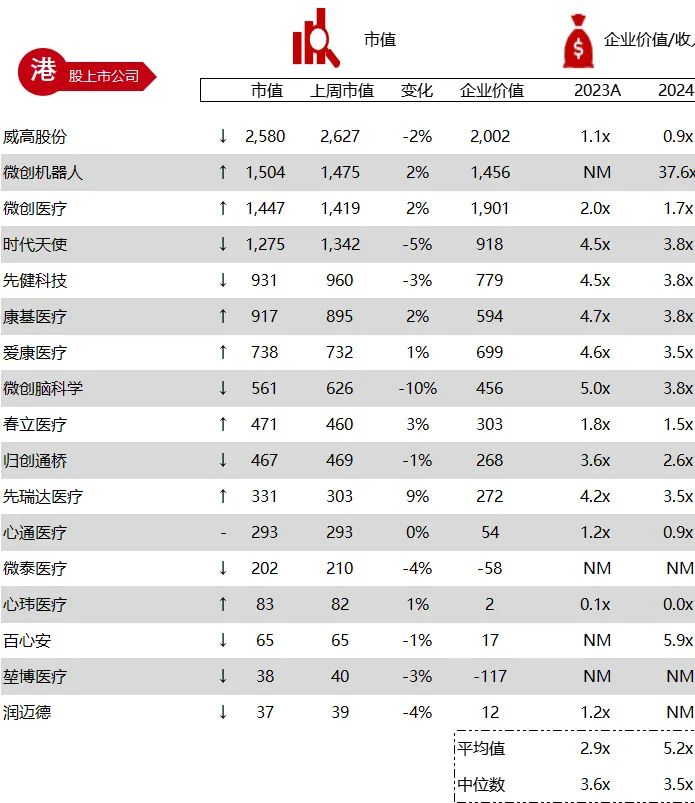
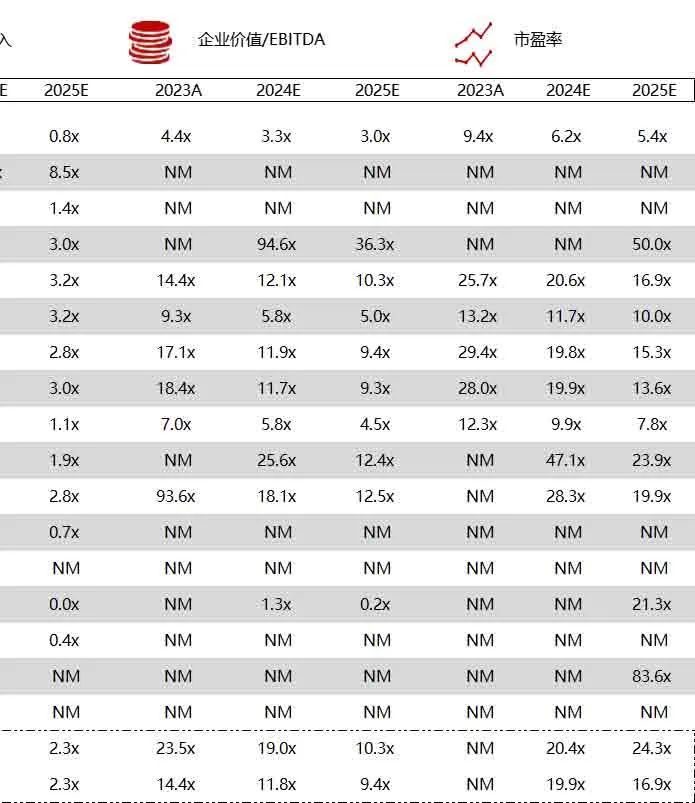
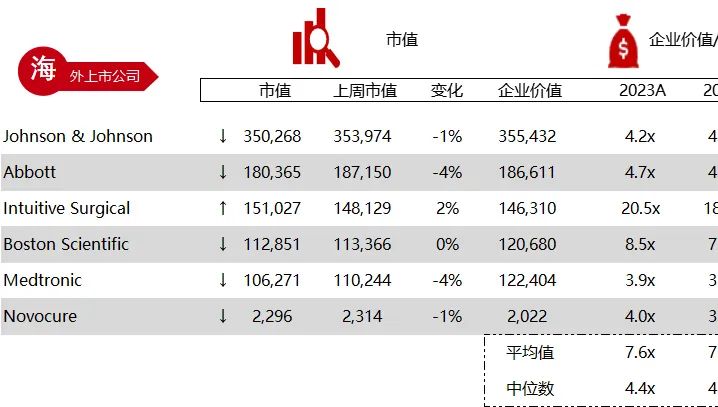
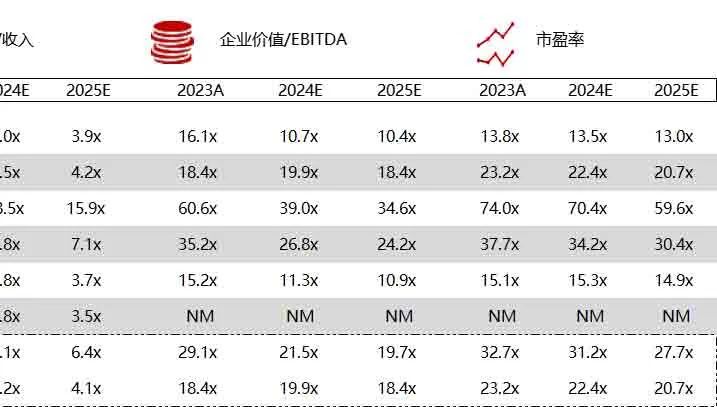
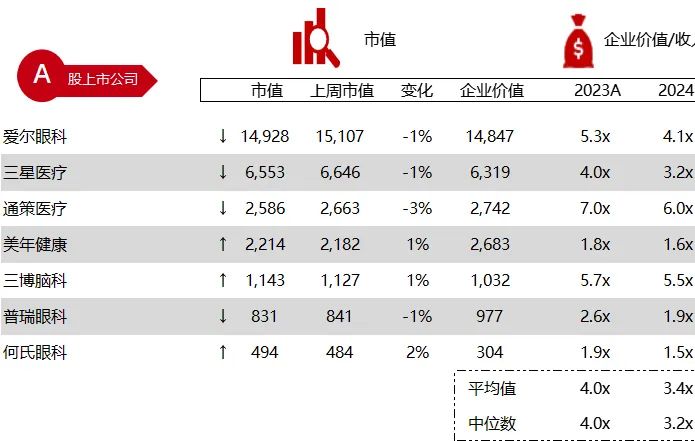
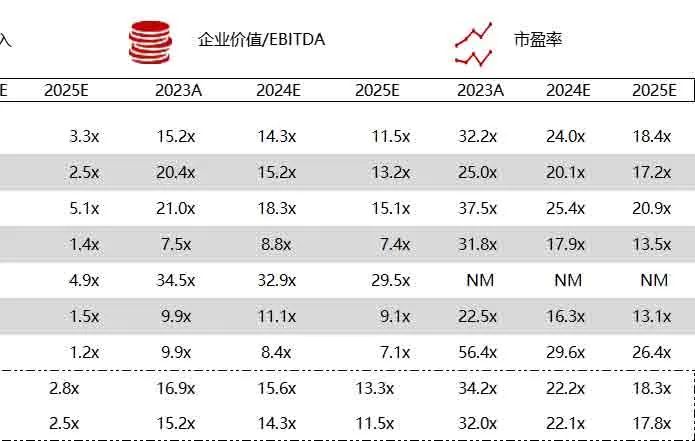
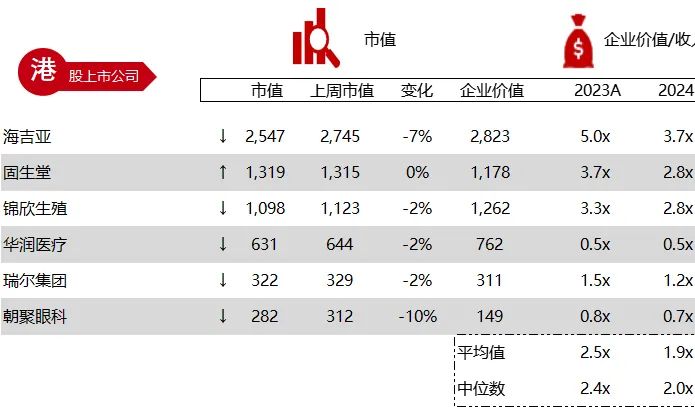
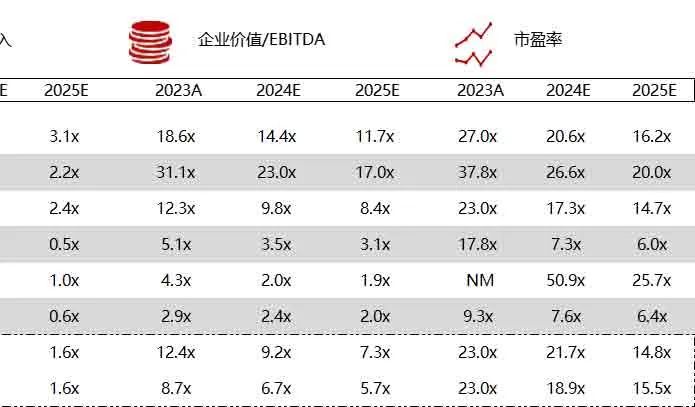
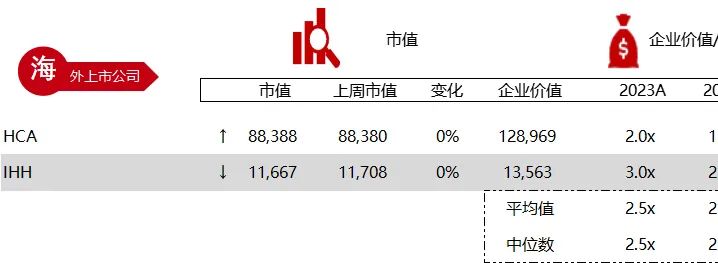
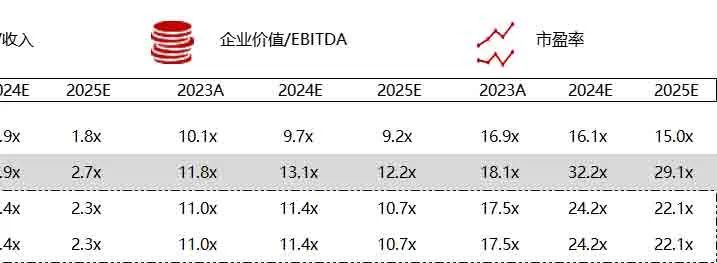
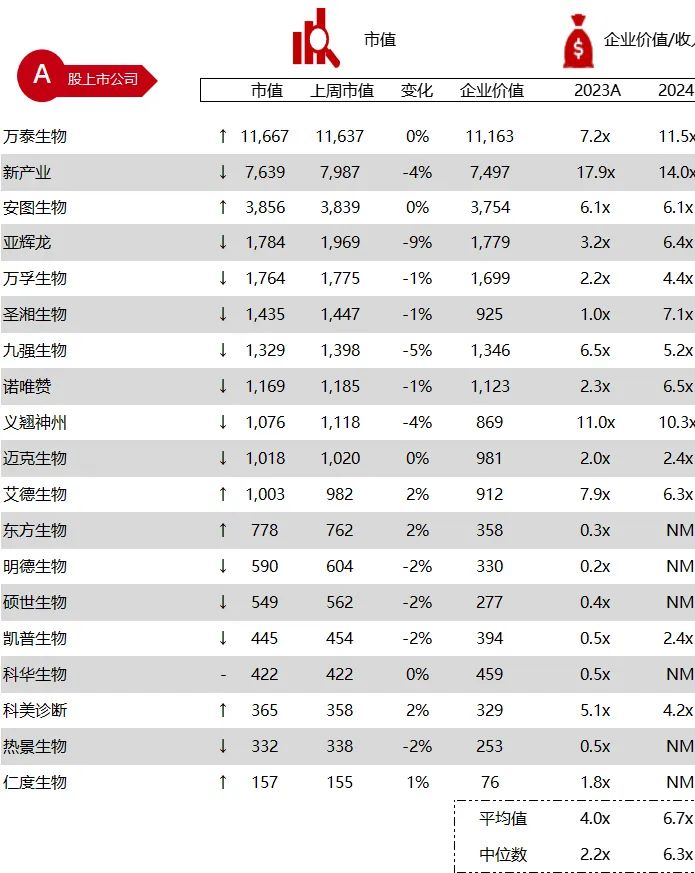
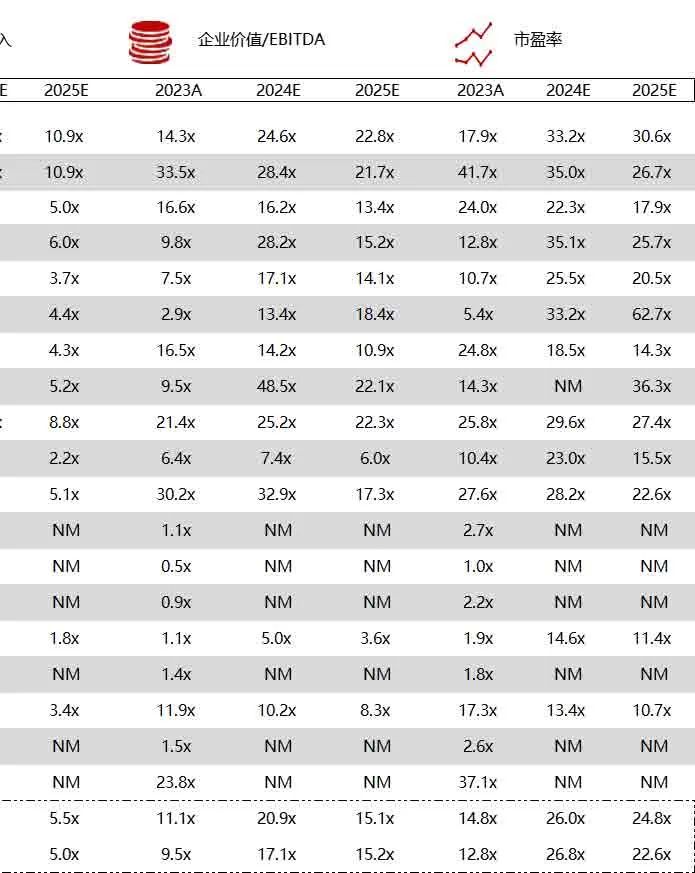
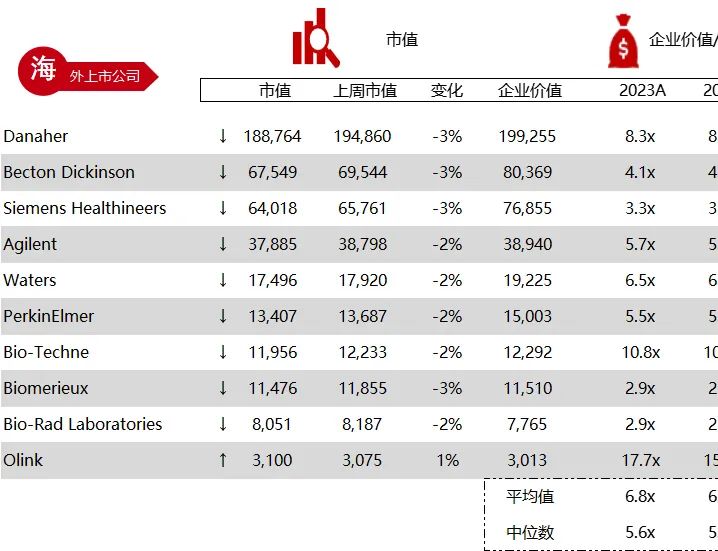
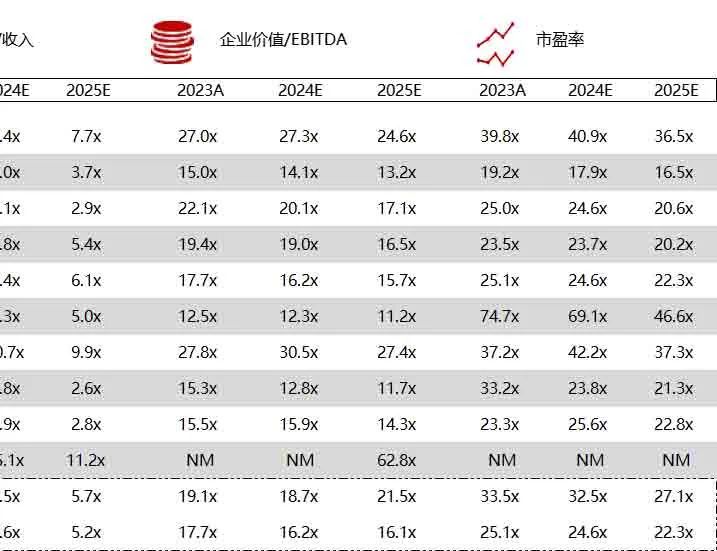
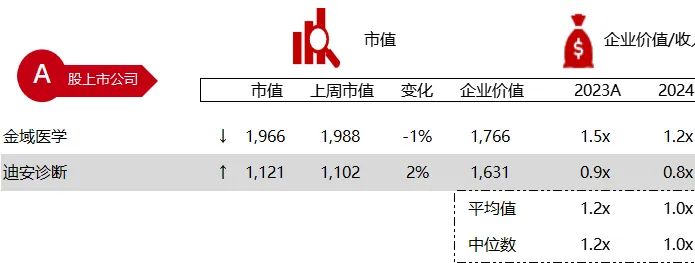
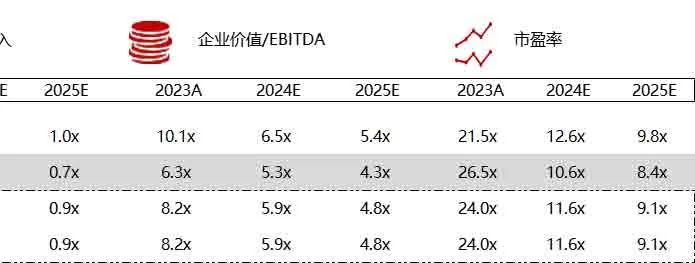
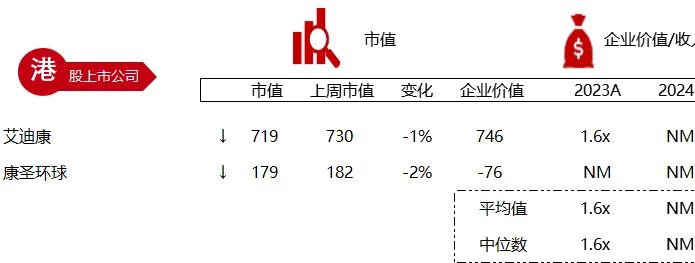
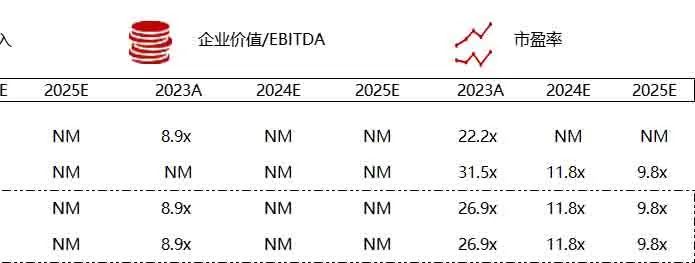
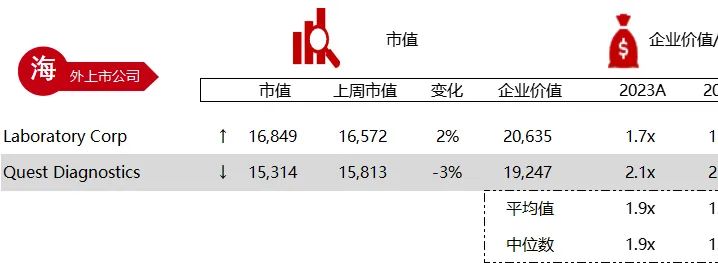
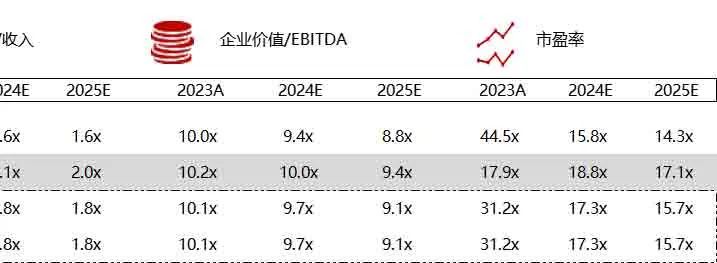
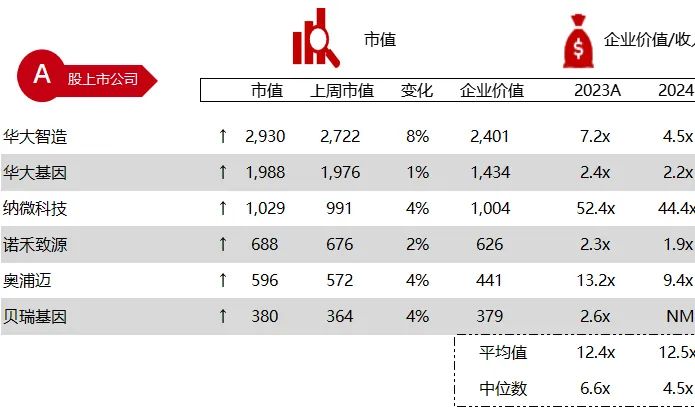
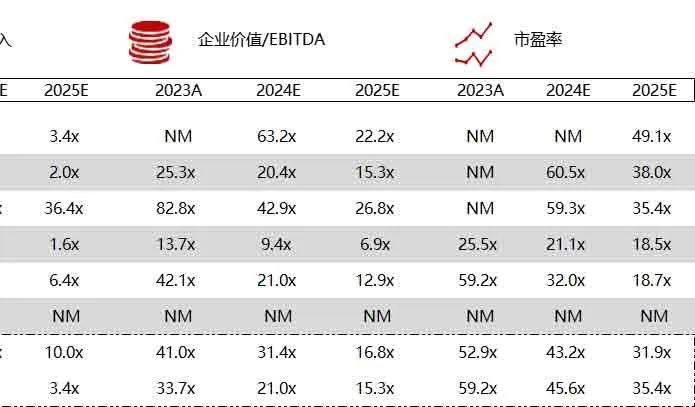
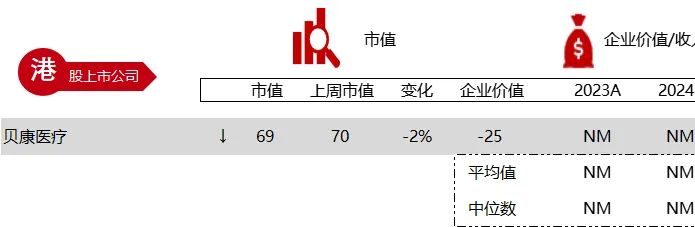
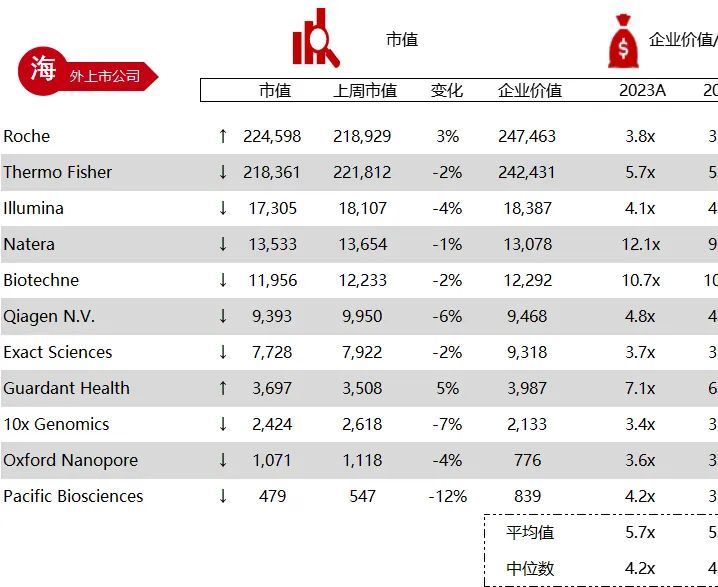
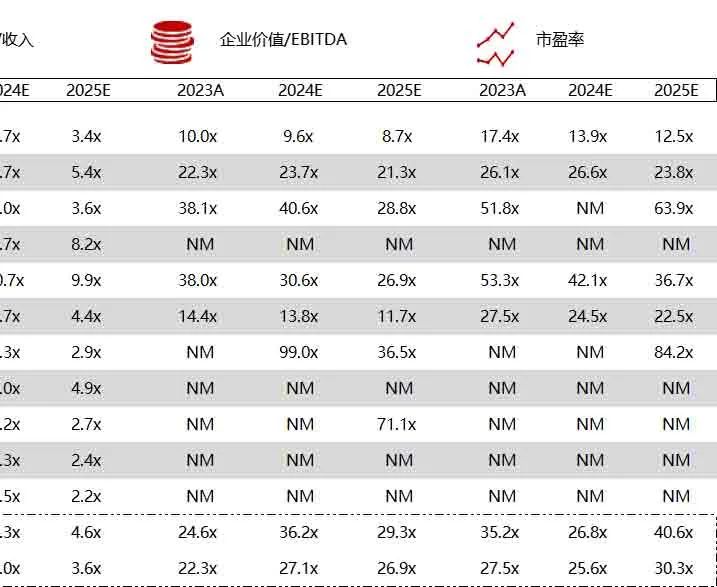
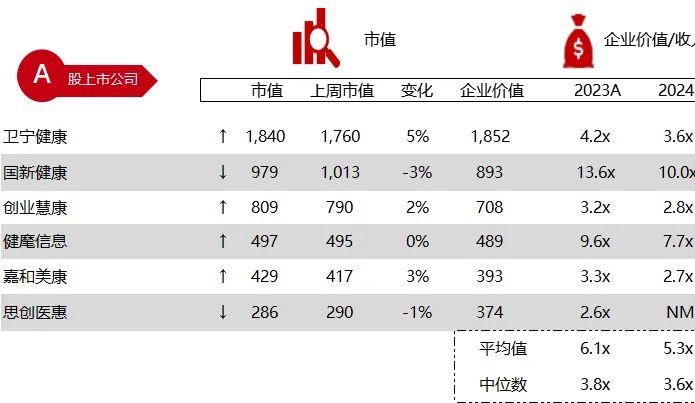
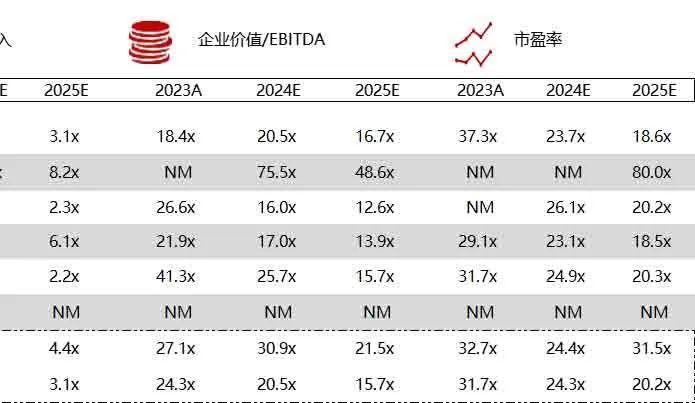
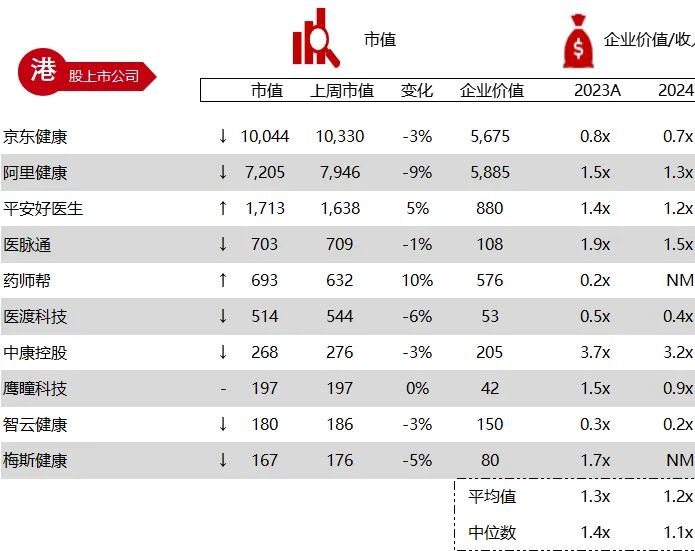
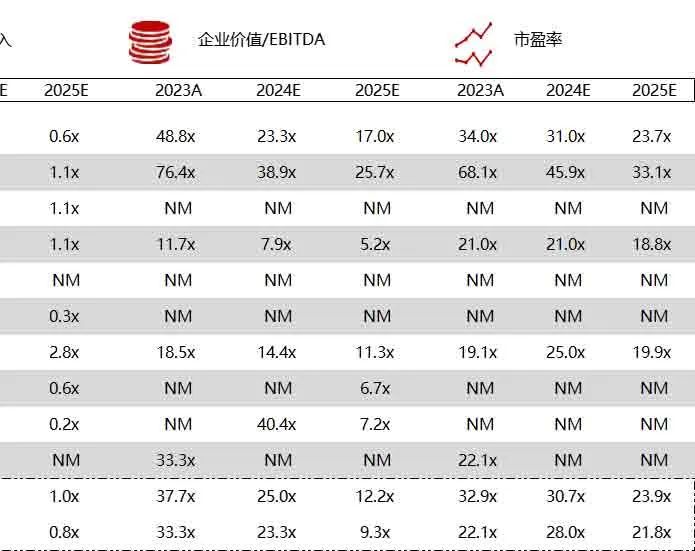
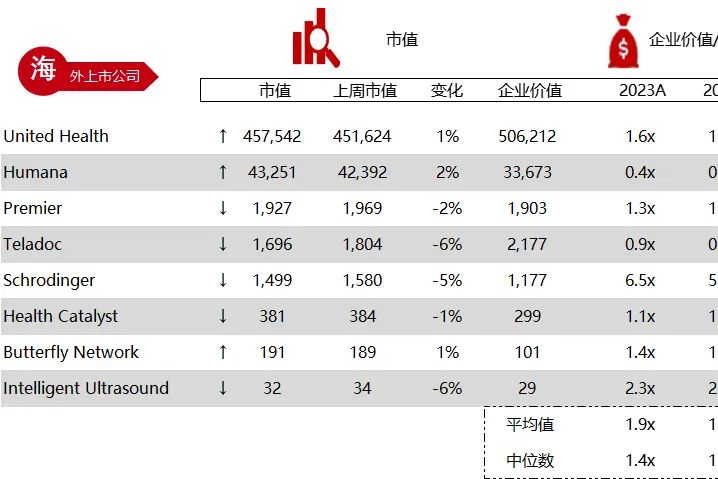
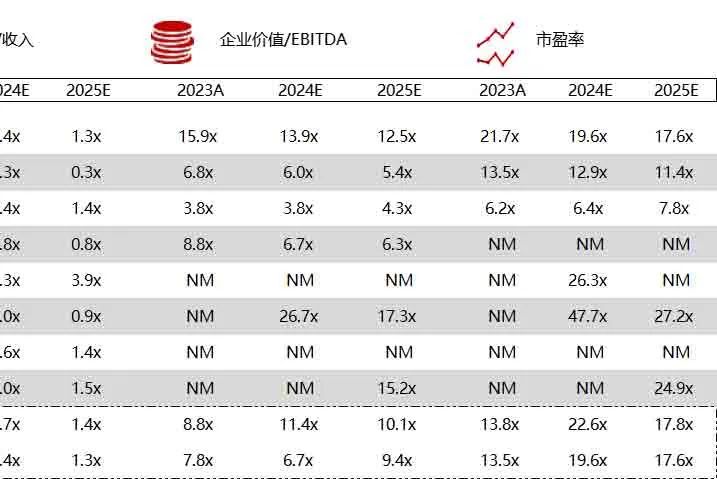
统计区间:2024年6月10日-6月14日
*数据来源:华兴资本内部整理
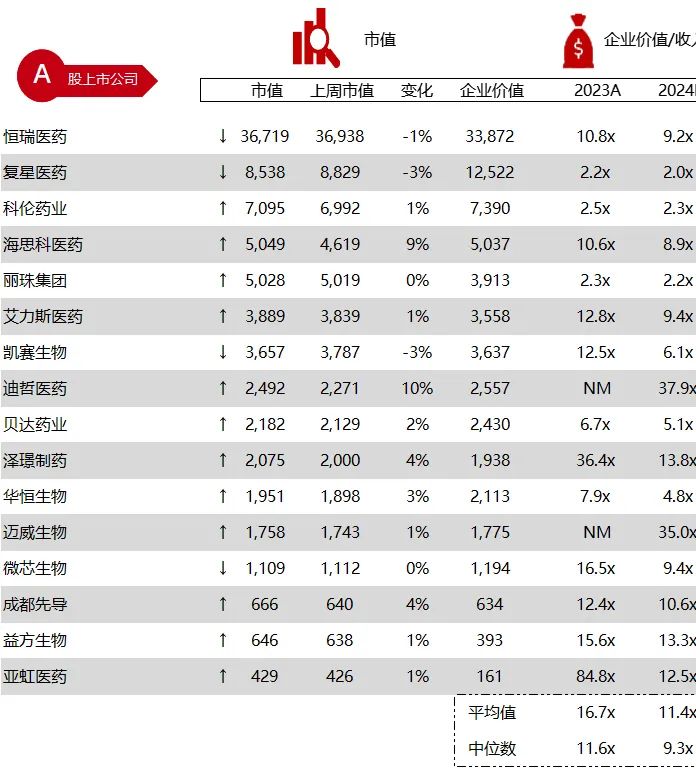
市值日期:2024年6月14日
市值单位:百万美元
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
*数据来源:Capital IQ、招股说明书、研报、公司年报
免责声明:本文由华兴资本集团(连同其关联公司,统称“华兴资本”)编写,谨供接收方作参考用途,并非作为也不应被视为在任何地区对任何证券的研究报告,不构成买卖、认购证券或其它金融工具及产品的邀请或保证。本文所提及的上市公司仅为示例,不代表任何投资分析或投资建议。接收方不应仅依靠本文、而应按照自己的判断作出投资决定,并在作出任何投资行动前,咨询专业意见。
本文所载资料的来源皆被华兴资本认为可靠,但华兴资本概不担保本文所含信息的准确性、完整性或新近度。本文所载的见解、分析、预测、推断和期望均截至本文的发表日期,且可能在未经事先通知的情况下调整。华兴资本与本文所提及的公司之间可能存在或寻求业务关系,因此,接收方请知悉可能存在的影响本文客观性的利益冲突。华兴资本不对因使用本文而承受的直接或间接损失承担任何责任。本文受到版权和资料全面保护。































精彩评论