“华兴资本医疗与生命科技行业周报”定期发布,专注从资本角度解读一周数据,并提供最新行业观察。
医疗与生命科技是华兴资本多年来关注并深耕的领域,目前已为近200个融资及并购项目担任财务顾问。
医疗与生命科技行业创新不断涌现,已经发展成为最活跃的行业之一,华兴资本始终支持、陪伴这一领域创业企业成长,致力为行业带来理性专业的声音。
作者 | 华兴资本医疗与生命科技团队
关注华兴资本微信公众号(ID:iChinaRenaissance),后台点击“兴观点”-“行业观察”-“生命科技”,获取更多医疗与生命科技行业相关信息。
标新生物获南湾百澳等机构A+轮融资
近日,标新生物医药科技(上海)有限公司宣布完成A+轮融资,投资方包括南湾百澳、司南园科、粤民投、黄埔医药基金等。此轮融资将助力标新生物加速医药科技研发进程。
行业视角:
标新生物是一家专注于医药科技研发的平台型企业。公司主要从事生物科技、生物医药、医药科技、医疗科技领域内的技术开发、技术咨询、技术服务、技术转让等业务。凭借深厚的技术积累和不断创新的能力,标新生物在医药科技领域取得了显著的成果。
普元生物完成数千万元Pre-A轮融资
近日,国内首批专注于研发自身免疫性疾病的微生物活体药企业杭州普元生物技术有限公司完成数千万元的Pre-A轮融资,这是继去年获得千万级的天使轮投资后,短短一年时间完成的第二轮融资。本次融资由兴华鼎立创投主投,西湖科创投跟投。普元生物表示,融资所获资金将用于自有PM001、PM002、PM005等明星菌株的进一步功能开发与临床研究、自营品牌吉布森益生菌的市场开发,以及研发和生产基地的建设。
行业视角:
公司由上海交通大学医学院梁启明教授创立,由浙江大学医学院王宇浩教授担任首席科学家。在深入研究肠道菌群对自身免疫系统影响的基础上,公司运用微生态制剂调节肠道菌群,调控人体免疫稳态,掌握了一系列自身免疫性疾病的预防和治疗新途径。目前,普元生物已经创建起“本土化”功能性菌种库,布局了上万株菌种资源,其中现有自主知识产权特性优良菌株超2600株,并且筛选出有关炎症性肠炎、多发性硬化、强直性脊柱炎、肝损伤、肿瘤免疫、糖尿病等适应症的多个明星菌株。
灵识质源完成天使轮融资
2024年5月27日,上海灵识质源生物技术有限公司宣布完成天使轮融资。本轮融资主要用于核心技术平台、核心管线分子的优化以及TCR药物管线的IIT临床试验工作。公司目前正积极推进下一轮A轮融资,并已获得多家知名生物医药投资机构的青睐及TS,预期将尽快完成A轮融资,加速核心管线的IND申报工作及临床推进。
行业视角:
灵识质源独立开发了“TCRMinerTM发现平台”和“可溶性TCR工程改造技术”两大技术平台,是一家具有TCR发现能力及TCR药物开发能力的平台型公司。
慧创医疗获近亿元B+轮融资
丹阳慧创医疗设备有限公司近日完成近亿元B+轮融资,这是公司在半年内获得的第二笔亿级融资。本轮融资由兴富资本、盛景嘉成联合领投,融资将用于加强公司近红外(fNIRS)脑功能成像在市场上的第一品牌优势地位,及经颅光调控治疗退行性疾病的临床试验和团队招募建设。
行业视角:
慧创医疗始终坚持创新引领,一直以来大力投入研发。公司组建了具备规模的研发团队,以创新高效的研发体系不断引领产学研方向。在多年研发积累下,公司不断将前沿学术成果转化为先进工程成果和创新市场产品。公司自主研制了世界首台获得医疗器械证的超100通道落地式近红外脑功能成像设备、世界首台获医疗器械证的便携式近红外脑功能成像设备和世界上获得中国医疗器械注册证的最高通道红外脑功能成像设备。
痛风医疗解决方案提供商 “艾麦锶”获数千万天使轮融资
5月28日消息,艾麦锶生命科技有限公司是一家致力于高尿酸血症及痛风精准检测和创新诊疗技术成果转化的科技企业,目前已获得苏州亿生资本数千万元人民币天使轮投资。
行业视角:
公司多项核心专利技术的研发过程最早要追溯到2016年由青岛大学代谢病研究院、泰山学者李长贵教授与中科院营养与健康研究所代谢质谱分析中心首席科学家尹慧勇教授(现任香港城市大学生命医学系终身教授)合作的科技部高尿酸与痛风的精准医学重点研发计划。
宇测生物完成数千万元Pre-B+轮融资
苏州宇测生物科技有限公司近日完成数千万元Pre-B+轮融资,本轮融资由领航新界独家投资。2024年至今,宇测生物已完成近亿元连续融资,持续以神经标志物为核心打造国产新一代免疫检测技术高端品牌,加速阿尔茨海默病早筛早诊市场布局。
行业视角:
宇测生物凭借自主开发的单分子免疫检测平台,率先布局国内神经血液标志物市场,通过构建“产学研”高效转化平台,打造高端技术品牌,树立学术影响旗帜,推进以神经科学为核心的新型生物标志物的临床转化与市场推广,并已与国内多家头部医院形成深度合作,发表多篇高影响力学术论文。
赛福基因完成亿元C轮融资
近日,赛福解码(北京)基因科技有限公司已完成亿元人民币C轮融资,本轮融资由锦江发展集团领投,中喜基金和部分老股东跟投。资金将主要用于推动医院LDT实验室共建并加快遗传/罕见病综合解决方案在顶级医疗机构的落地、加速出生缺陷三级防控产品研发与注册,以深化集团在遗传/罕见病精准防控与诊疗一体化方向上的布局。
行业视角:
赛福基因专注于基因大数据AI解析,为遗传病患者提供精准医疗服务。拥有CAP认证的第三方医学检验实验室和美国医学遗传学会(ABMGG)临床分子遗传学资质,自建功能验证及高通量药物筛选平台,业务涵盖基于高通量测序的遗传病辅助诊断和出生缺陷三级防控诊筛产品,以及转化医学和药物研发服务,实现临床-科研-药物研发防诊疗闭环化运营。以斑马鱼为核心的创新技术平台可实现高效的基因功能验证和高通量药物筛选,以满足遗传病患者精准诊断的需求,助力中国临床科研进展,赋能药物研发企业快速进入新阶段。
心永科技获数千万元A轮融资
5月31日消息,医疗级传感器、连续血压监测技术提供商“心永科技”近日完成数千万元人民币A轮融资,由兴富资本领投,老股东峰瑞资本跟投,本轮融资主要用于传感器底层技术升级、血流动力学模型算法优化、第三代连续血压监测产品量产等。
行业视角:
心永科技联合创始人李毅彬毕业于清华大学微电子系,在血压监测方面已深耕10余年;联合创始人魏耀广主持血流动力学模型、信号补偿调优等算法开发,创始合伙人文武主要推动传感器设计、工艺开发、供应链和系统硬件开发并主持项目开展等。
默沙东收购EyeBio公司
当地时间5月29日,默沙东(MSD)和EyeBiotech Limited(EyeBio)联合宣布,两家公司已达成最终协议,默沙东将通过一家子公司以13亿美元的前期付款和高达17亿美元的未来里程碑付款收购EyeBio公司。本次收购潜在总价值30亿美元。
行业视角:
EyeBio是一家处于临床阶段的眼科生物技术公司,致力于开发和提供新一代疗法,以保护、恢复和改善威胁视力的眼病患者的视力。EyeBio由医学博士David Guyer和医学博士Tony Adamis以及SV Health Investors于2021年8月创立,其领导团队在眼科药物开发方面拥有世界一流的记录。
Moderna RSV疫苗获FDA批准上市
BMS CAR-T疗法Breyanzi获FDA批准新适应症,治疗套细胞淋巴瘤
FDA批准可乐定缓释混悬剂,用于注意力缺陷多动症
卫材/渤健阿尔茨海默病抗体新药在韩国获批上市
琅铧医药“替洛利生片”新适应症获批上市
爱施健(aspen)醋酸氟氢可的松片在中国获批上市
多款医疗器械产品获批上市
Moderna RSV疫苗获FDA批准上市
5月31日,Moderna宣布FDA已经批准呼吸道合胞病毒(RSV)疫苗mRESVIA(mRNA-1345)上市,用来预防60岁及以上人群出现由RSV引起的下呼吸道疾病(LRTD)。
信息来源:医药魔方
BMS CAR-T疗法Breyanzi获FDA批准新适应症,治疗套细胞淋巴瘤
5月30日,BMS宣布FDA已经批准Breyanzi(lisocabtagene maraleucel,liso-cel)用于治疗复发或难治性套细胞淋巴瘤(MCL)成人患者,这些患者既往接受过至少两种全身治疗,包括一种BTK抑制剂。
信息来源:医药魔方Info
FDA批准可乐定缓释混悬剂,用于注意力缺陷多动症
5月29日,Tris Pharma宣布FDA已经批准ONYDA™ XR(盐酸可乐定)上市,用来单药治疗或者辅助中枢兴奋剂药物治疗6岁及以上注意力缺陷多动症(ADHD)患者。这是FDA批准的首款也是唯一一款液体非兴奋剂类ADHD药物。
信息来源:医药魔方Info
卫材/渤健阿尔茨海默病抗体新药在韩国获批上市
5月27日,卫材(Eisai)和渤健(Biogen)宣布,韩国食品药品安全部(MFDS)已批准人源化抗可溶性β淀粉样蛋白(Aβ)单克隆抗体lecanemab(中文通用名:仑卡奈单抗)上市,用于治疗早期(轻度)阿尔茨海默病或由阿尔茨海默病引起的轻度认知障碍成人患者。根据卫材新闻稿,这是继美国、日本、中国之后,lecanemab在第四个国家获批上市。
信息来源:医药观澜
琅铧医药“替洛利生片”新适应症获批上市
5月27日,NMPA官网显示,琅铧医药引进的盐酸替洛利生片(Pitolisant)获批新适应症,用于治疗发作性睡病青少年和6岁以上儿童患者的日间过度嗜睡(EDS)或猝倒。
信息来源:医药魔方Info
爱施健(aspen)醋酸氟氢可的松片在中国获批上市
5月27日,爱施健(aspen)宣布醋酸氟氢可的松片上市申请已获得中国国家药监局(NMPA)批准,用于治疗失盐型先天性肾上腺皮质增生症(CAH)和失盐型原发性慢性肾上腺皮质功能减退症(Addison病,艾迪生病)。
信息来源:医药观澜
多款医疗器械产品获批上市
近日,脉冲消融创新技术公司Galvanize Therapeutics宣布,其Inumi Flex内窥镜针已获得美国食品药品监督管理局(FDA)510(k)监管清除,可与Aliya PEF系统一起用于软组织消融。
信息来源:器械之家
近日,北京昆迈医疗科技有限公司自主研发的“脑磁图系统”获得NMPA批准上市(注册证编号:京械注准20242070274),成为全球首款基于原子磁强计(也称光泵磁强计,即OPM)技术获批的无液氦脑磁图设备。
信息来源:动脉网
近日,上海汇禾医疗科技股份有限公司自主研发的冠状动脉血管内冲击波治疗系统正式获得国家药品监督管理局(NMPA)批准上市。这是全球首款采用独特S形螺旋式电极设计的冲击波导管,同时也是中国首个兼有冠脉和外周血管适应症的国产冲击波导管及系统。
信息来源:医疗器械创新网
2024年5月28日,蓝帆医疗股份有限公司发布公告称:心脑血管事业部子公司上海蓝帆博元医疗科技有限公司自主研发的三类医疗器械产品一次性使用冠脉血管内冲击波导管——Soni Cracker™-CL(国械注准20243030988)经过中国国家药品监督管理局(NMPA)的审查批准,正式获得 NMPA 医疗器械注册证。
信息来源:思宇MedTech
2024年5月28日,NMPA批准了北京品驰医疗设备有限公司的植入式脑深部电刺激电极导线套件、双通道可充电植入式脑深部电刺激脉冲发生器套件、双通道植入式脑深部电刺激脉冲发生器套件和植入式脑深部电刺激延伸导线套件等4个创新产品注册申请。
信息来源:医疗器械创新网
近日,眼科手术设备领域的领先创新者 New World Medical 宣布,其KDB(Kahook Dual Blade) GLIDE® 获得FDA 510(k)批准,用于扩大青光眼治疗适应症。
信息来源:思宇MedTech
辉瑞公布第三代ALK抑制剂长期随访结果
康方PD-1/VEGF双抗一线治疗NSCLC III期研究成功
轻/中度斑秃疗法II期研究成功
科伦博泰:SKB264实现三阴乳腺癌临床突破
阿斯利康潜在“first-in-class"小分子临床数据亮眼
突破性双抗一线组合疗法3期试验即将启动
突破性小分子疗法达到3期临床主要终点,即将递交上市申请
阿斯利康在中国启动齐泊腾坦/达格列净治疗慢性肾病III期研究
辉瑞公布第三代ALK抑制剂长期随访结果
5月31日,辉瑞(Pfizer)公司于正在举行的2024年美国临床肿瘤学会年会(ASCO)年会上,以口头报告的形式公布了3期CROWN研究的长期随访结果。这项研究旨在评估第三代ALK抑制剂洛拉替尼对比第一代ALK抑制剂在既往未经治疗的间变性淋巴瘤激酶(ALK)阳性晚期非小细胞肺癌(NSCLC)患者中的疗效。数据显示,60%的患者在五年后仍未发生疾病进展或死亡。与第一代ALK抑制剂相比,使用洛拉替尼治疗的患者疾病进展或死亡风险持续降低81%,脑转移进展风险降低94%。
信息来源:医药观澜
康方PD-1/VEGF双抗一线治疗NSCLC III期研究成功
5月31日,康方生物宣布,全球首创双特异性抗体新药依沃西单抗(PD-1/VEGF双抗)单药对比帕博利珠单抗一线治疗PD-L1表达阳性(PD-L1 TPS≥1%)的局部晚期或转移性非小细胞肺癌(NSCLC)的注册性III期临床研究(HARMONi-2或AK112-303),由独立数据监察委员会(IDMC)进行的预先设定的期中分析显示强阳性结果:达到无进展生存期(PFS)的主要研究终点。
信息来源:医药魔方
轻/中度斑秃疗法II期研究成功
5月30日,Soterios Pharma宣布,其非甾体类局部疗法STS-01治疗轻度/中度斑秃的II期研究取得了积极结果。据公司新闻稿,STS-01有可能成为第一个获批的轻度/中度斑秃疗法和护理标准。
信息来源:医药魔方
科伦博泰:SKB264实现三阴乳腺癌临床突破
2024年5月31日至6月4日,2024年美国临床肿瘤学会(ASCO)年会在美国伊利诺伊州芝加哥市举行,科伦博泰SKB264用于治疗局部复发性或转移性三阴乳腺癌三期临床OptiTROP-Breast01的最新数据,将于美国当地时间6月2日上午09:45-11:45在“Clinical Science Symposium-Next Generation Antibody-Drug Conjugates, Ther Revolution Continues” Session进行口头报告,Session类型为clinical sicence Symposium,为special session。日前,该报告的摘要数据已经公布。
信息来源:医药笔记
阿斯利康潜在“first-in-class"小分子临床数据亮眼
阿斯利康(AstraZeneca)在欧洲动脉粥样硬化学会(EAS)公布其在研口服PCSK9抑制剂AZD0780于1期临床试验中取得积极结果。当AZD0780与他汀类药物瑞舒伐他汀(rosuvastatin)联用时,可降低患者低密度脂蛋白胆固醇(LDL-C)水平近80%。AZD0780已在今年1月进入2b期临床试验用于治疗血脂异常患者。
信息来源:药明康德
突破性双抗一线组合疗法3期试验即将启动
Merus公布其在研双特异性抗体petosemtamab与PD-1抑制剂pembrolizumab作为一线联合疗法,治疗头颈癌患者的1/2期临床试验的积极数据。在此中期数据中,接受petosemtamab联合疗法患者的总缓解率达67%,无论患者肿瘤PD-L1表达水平与人类乳头瘤病毒(HPV)状态为何。Merus计划于2024年底启动petosemtamab与pembrolizumab联合疗法用于一线治疗PD-L1表达头颈癌患者的3期注册试验,无论患者的HPV状态为何。
信息来源:药明康德
突破性小分子疗法达到3期临床主要终点,即将递交上市申请
Insmed宣布了3期临床试验ASPEN的积极顶线结果。这是一项全球性随机双盲、含安慰剂对照的研究,评估了brensocatib在非囊性纤维化支气管扩张症患者中的疗效、安全性和耐受性。研究达到了主要终点,两种剂量的brensocatib与安慰剂相比,均显著降低年化肺部症状恶化(PE)率。基于这些结果,Insmed计划在2024年第四季度向美国FDA提交brensocatib的新药申请(NDA)。新闻稿指出,如果获得批准,brensocatib将成为首个获批治疗支气管扩张症的药物,同时也是首个获批的二肽基肽酶1(DPP1)抑制剂,这代表着一种具有潜力治疗多种中性粒细胞介导疾病的新作用机制。
信息来源:药明康德
阿斯利康在中国启动齐泊腾坦/达格列净治疗慢性肾病III期研究
近日,药物临床试验登记与信息公示平台显示,阿斯利康在中国登记了齐泊腾坦(zibotentan)/达格列净复方治疗慢性肾脏病伴高蛋白尿的III期、随机、多中心、双盲研究。
信息来源:医药魔方Info
三生蔓迪与翰宇药业签署《司美格鲁肽注射液合作协议》
强生囊获潜在“first-in-class”双抗疗法,治疗特应性皮炎
BMS再次牵手Prothena,引进第2款神经退行性疾病药物
百奥泰将戈利木单抗生物类似药欧洲市场权益授权给STADA
宜联生物宣布与BioNTech达成多靶点TMALIN® ADC技术平台授权协议
三生蔓迪与翰宇药业签署《司美格鲁肽注射液合作协议》
5月28日,三生制药发布公告,其附属公司沈阳三生制药有限责任公司的全资附属公司浙江三生蔓迪药业有限公司(三生蔓迪)与深圳翰宇药业股份有限公司(翰宇药业)签署《司美格鲁肽注射液合作协议》。
信息来源:药融圈
强生囊获潜在“first-in-class”双抗疗法,治疗特应性皮炎
强生公司宣布已与Numab Therapeutics达成一项最终协议,将斥资约12.5亿美元收购潜在“first-in-class”双特异性抗体NM26的全球研发权益。
信息来源:药明康德
BMS再次牵手Prothena,引进第2款神经退行性疾病药物
5月28日,Prothena Corporation宣布,百时美施贵宝(BMS)获得了该公司神经退行性疾病潜在治疗药物PRX019的独家全球许可。根据协议,BMS将向Prothena支付8000万美元预付款,Prothena还将有资格获得高达6.175亿美元的额外开发、监管和销售里程碑付款,以及净销售额的分层版税。
信息来源:医药魔方
百奥泰将戈利木单抗生物类似药欧洲市场权益授权给STADA
5月28日,百奥泰生物宣布已与STADA Arzneimittel AG就BAT2506(一款参照欣普尼®戈利木单抗开发的生物类似药)签署授权许可及商业化协议,STADA将拥有BAT2506在欧盟、英国、瑞士以及其他部分欧洲国家市场的独占的商业化权益。
信息来源:医药魔方Info
宜联生物宣布与BioNTech达成多靶点TMALIN® ADC技术平台授权协议
2024年5月27日 - 苏州宜联生物医药有限公司,一家临床阶段的生物科技公司,宣布与BioNTech SE,一家开创性研发肿瘤和其他重症治疗药物的下一代免疫治疗公司,达成一项新的战略合作。基于本次合作,BioNTech将获得一项利用宜联生物TMALIN® ADC技术平台开发针对限定的某几个前沿创新靶点的ADC产品的独家选择权及相应全球独家许可。根据新协议条款,宜联生物将获得2500万美元的首付款,并有资格获得最高可达18亿美元的开发、监管和商业化里程碑付款,以及未来基于全球年度销售净额的梯度特许权使用费。
信息来源:苏州宜联生物
医用敷料龙头主板注册已生效
2024年5月28日,上交所官网显示,健尔康医疗科技股份有限公司主板注册已生效,其保荐机构为中信建投证券股份有限公司,拟募集资金7.2亿元。
信息来源:思宇MedTech
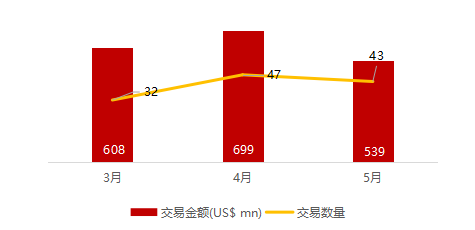
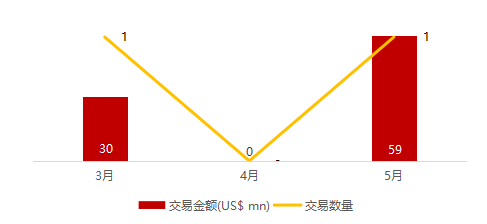
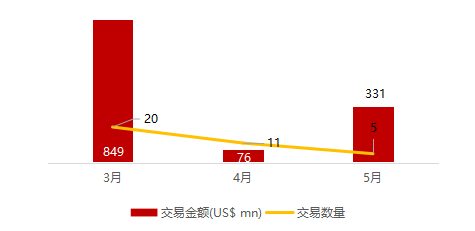
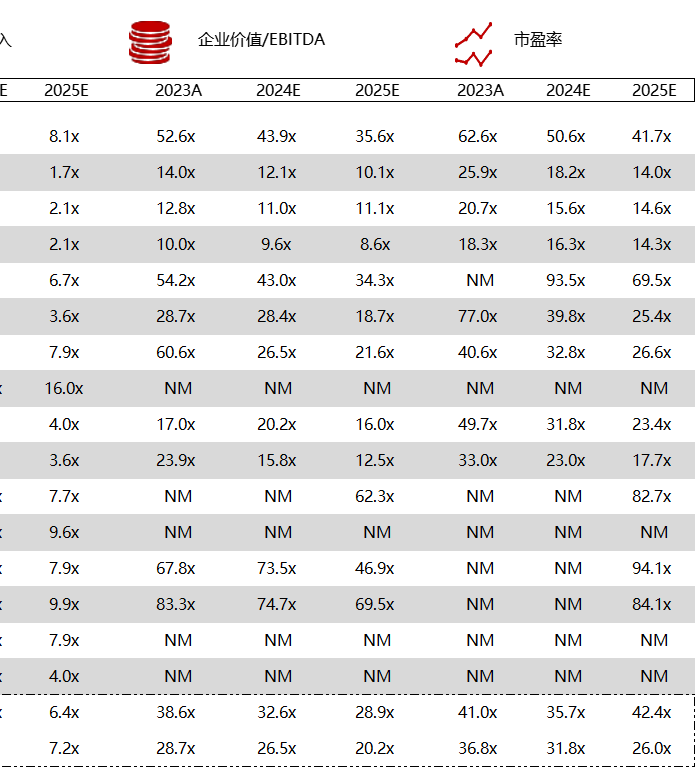
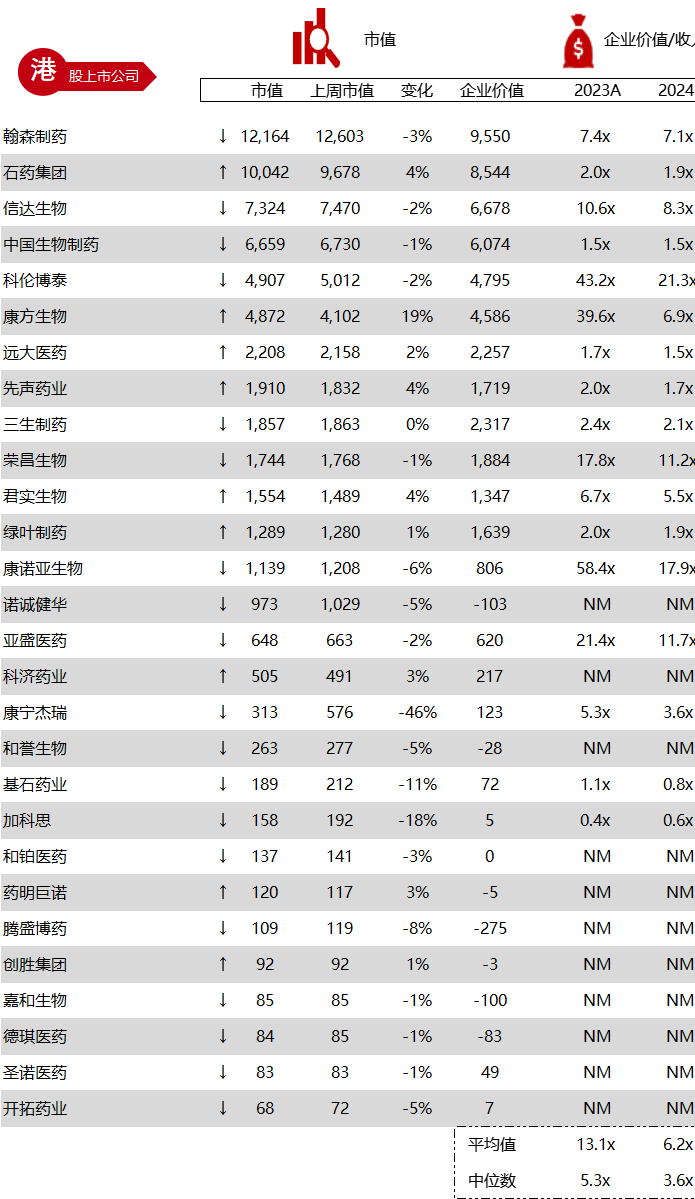
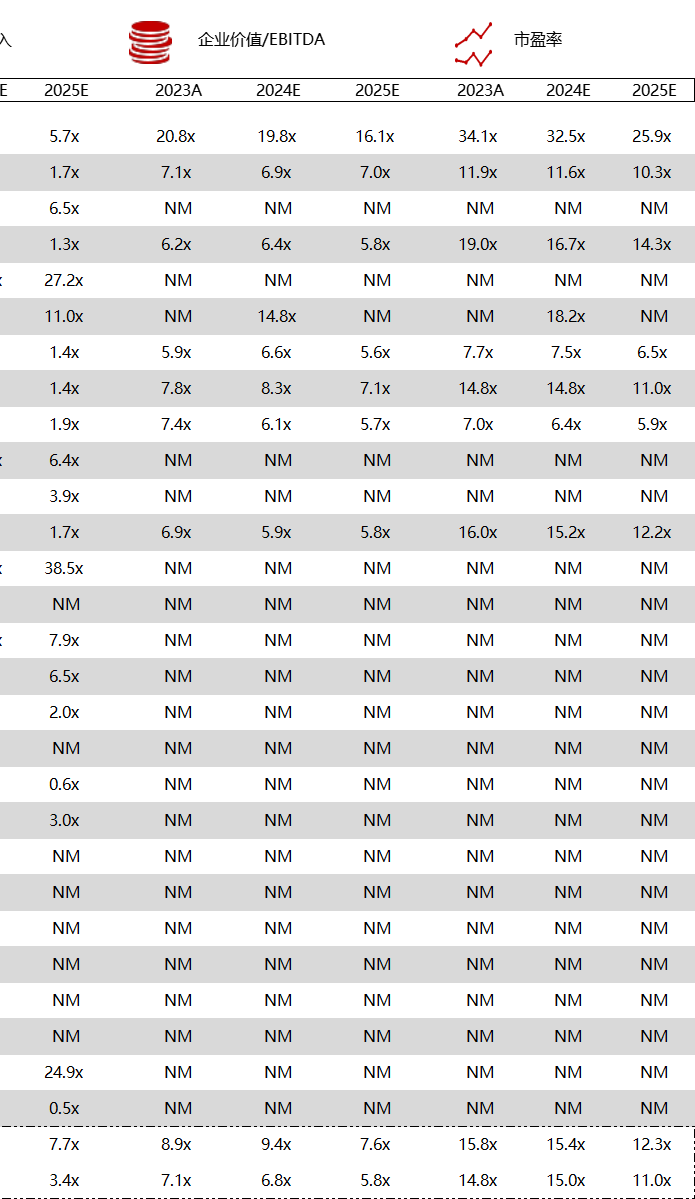
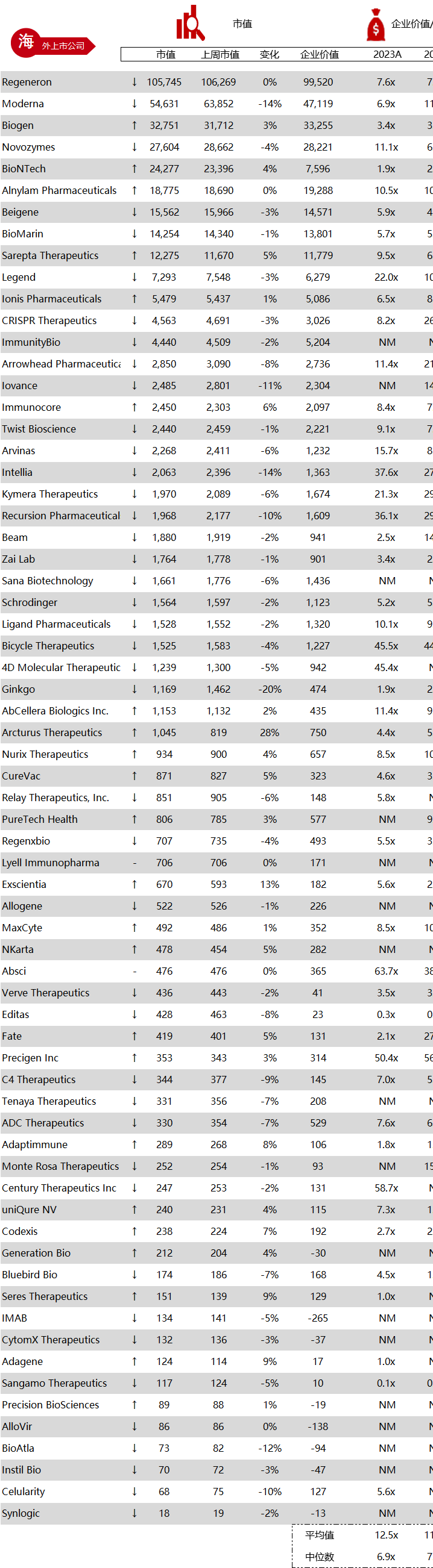
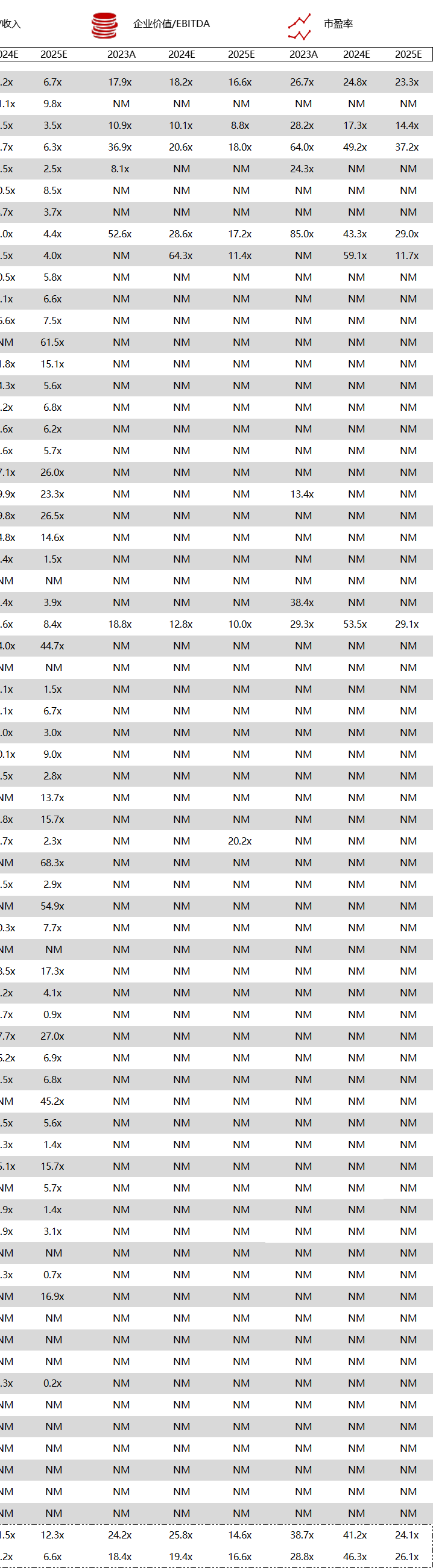
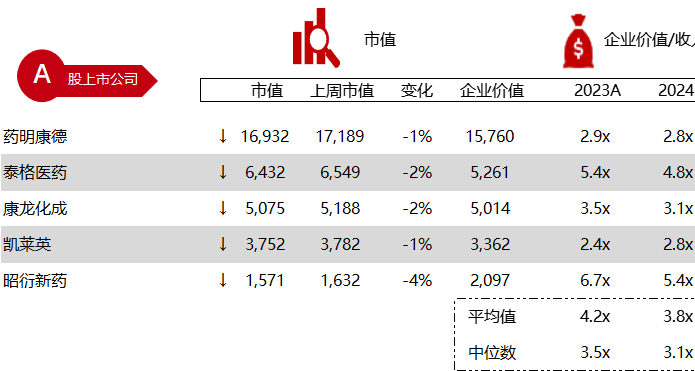
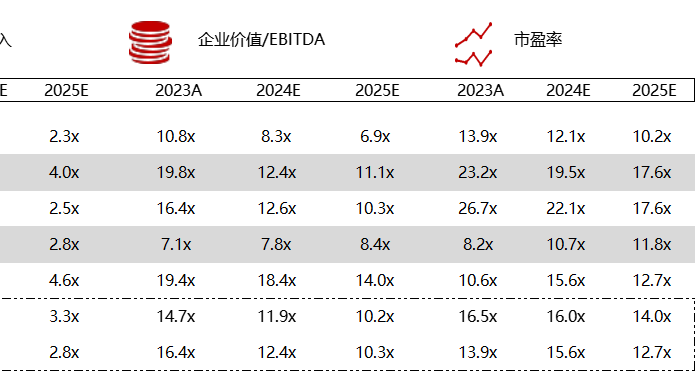
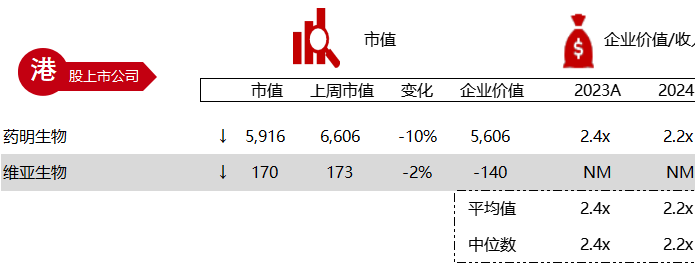
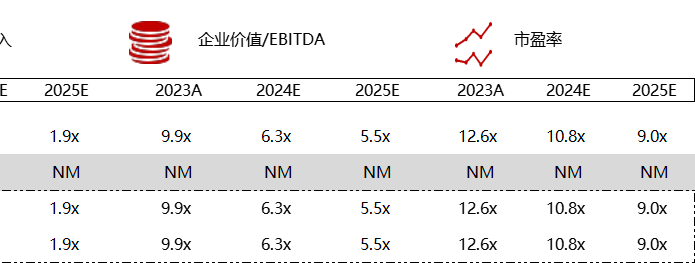
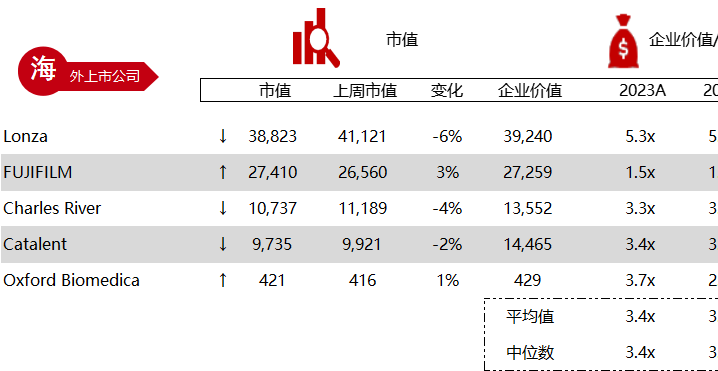
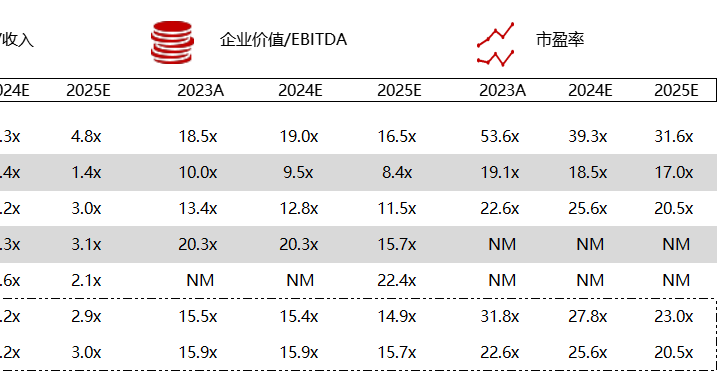
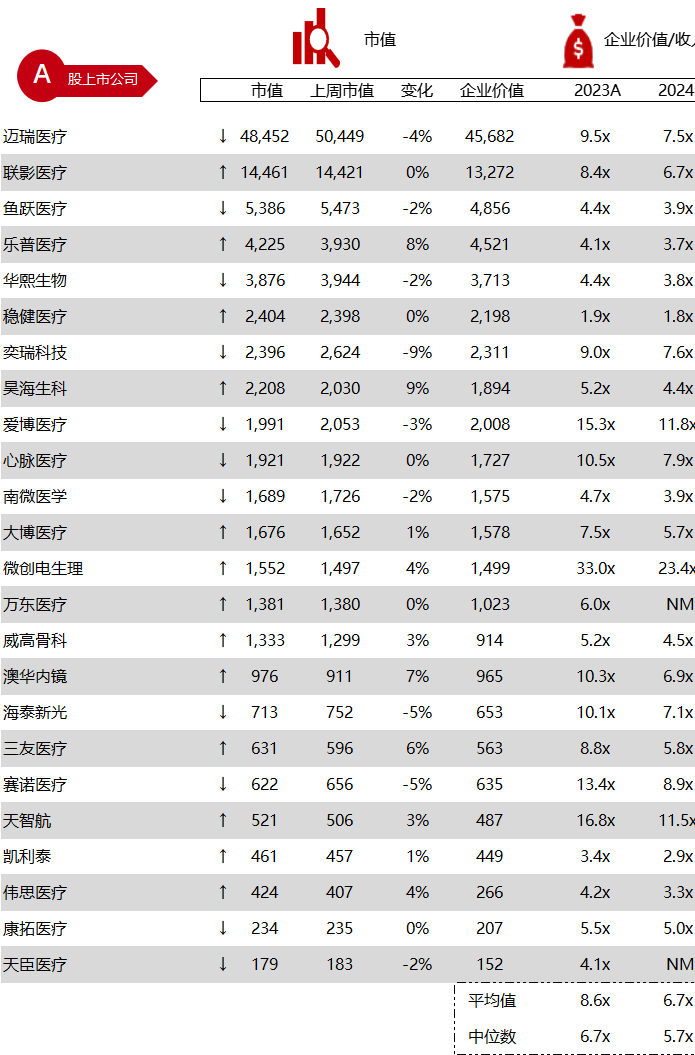
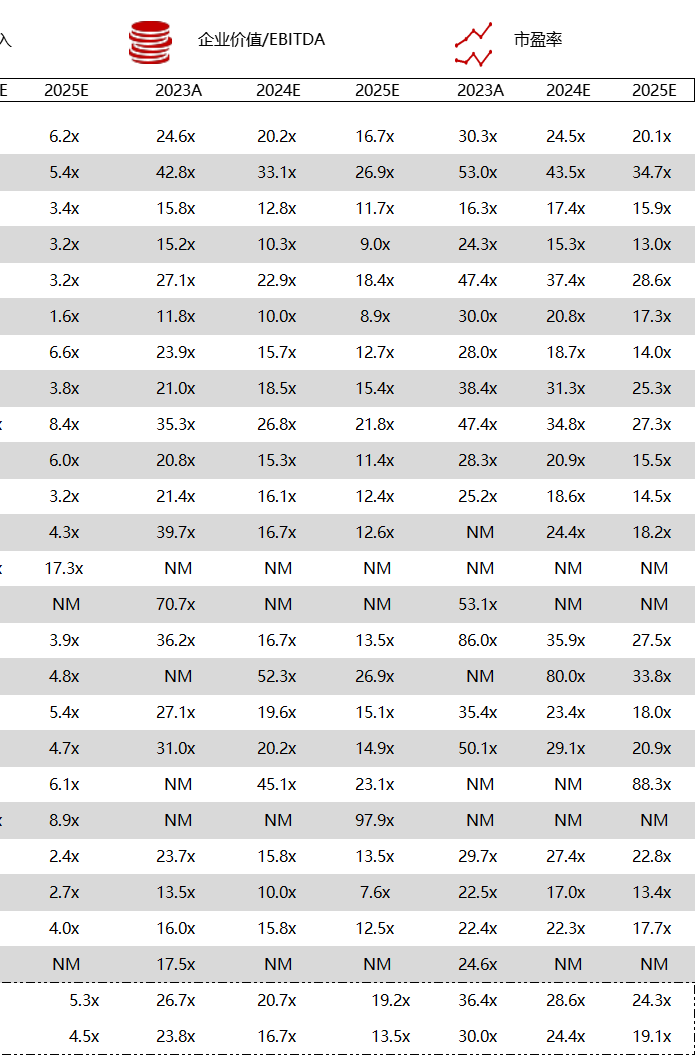
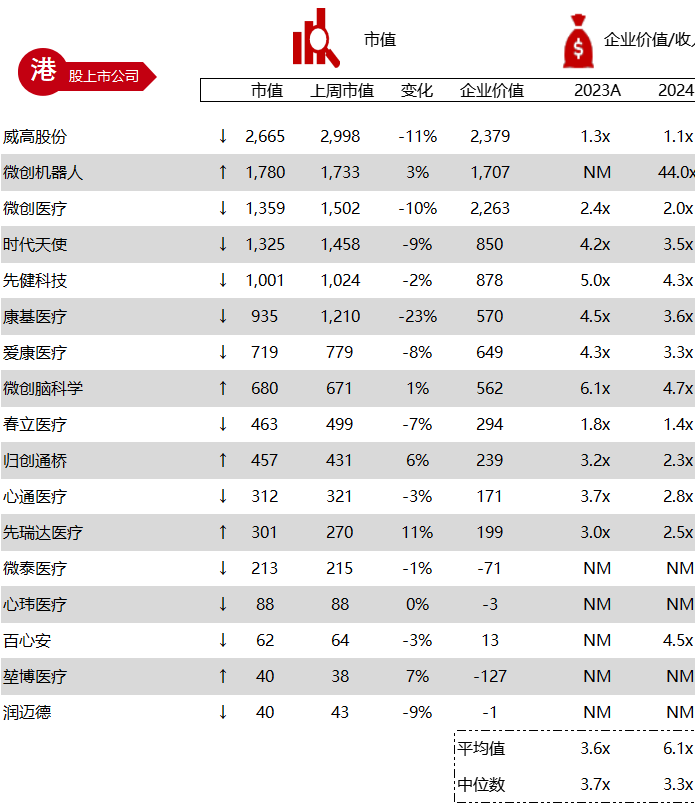
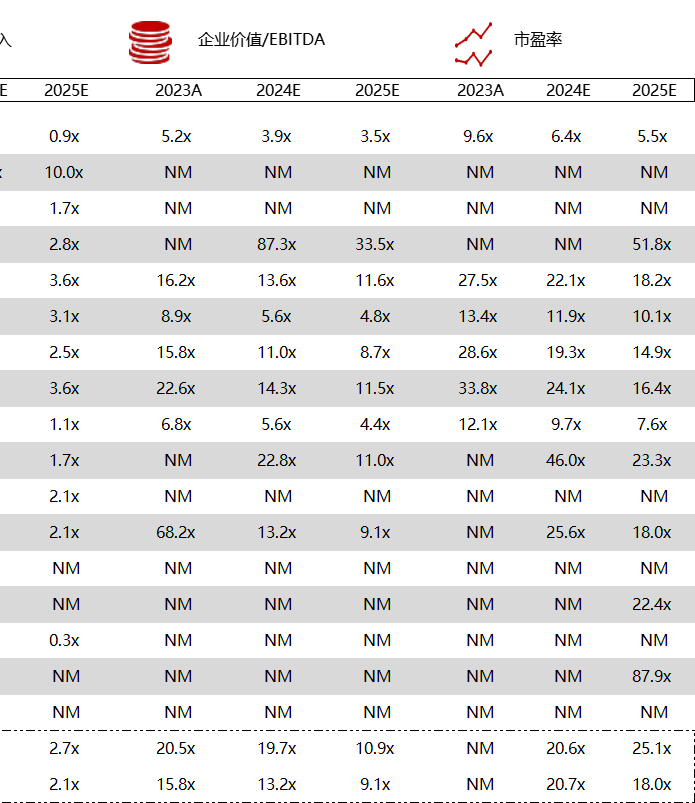
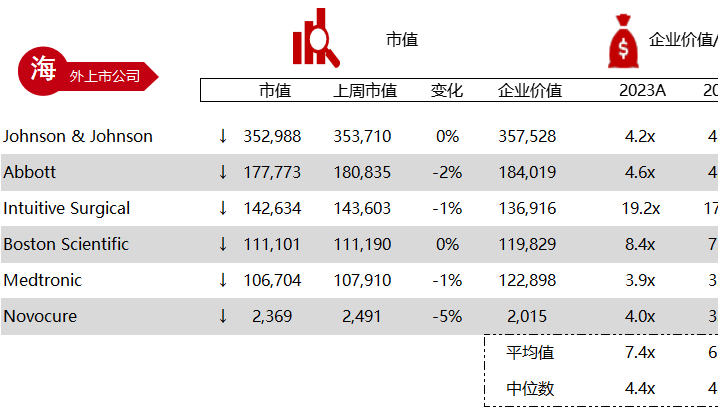
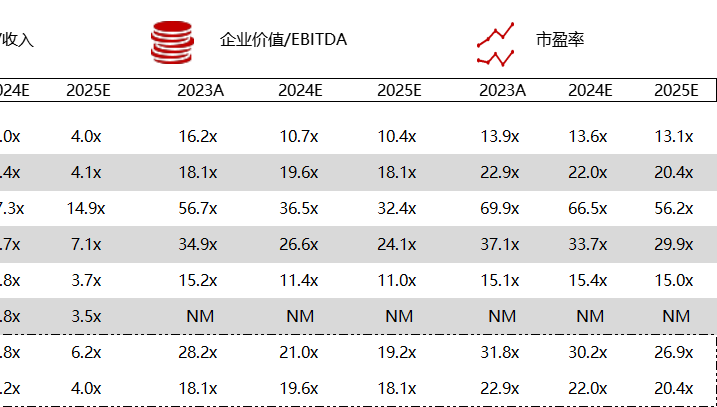
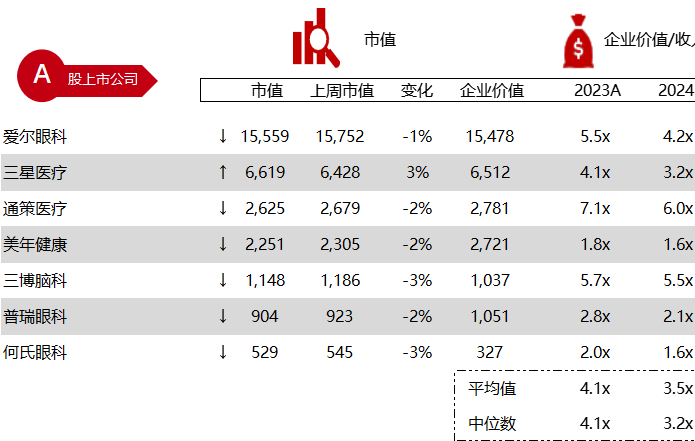
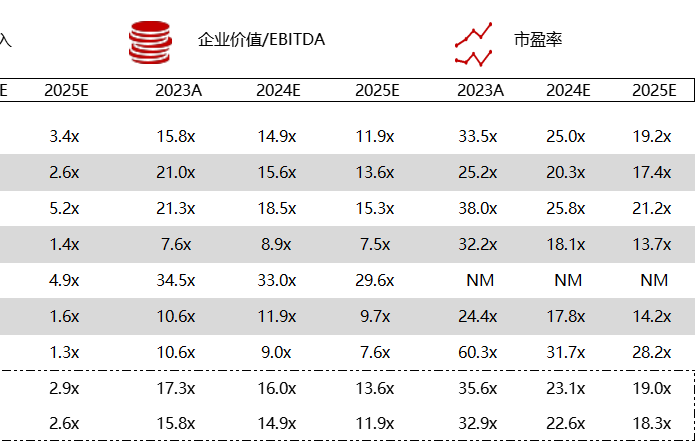
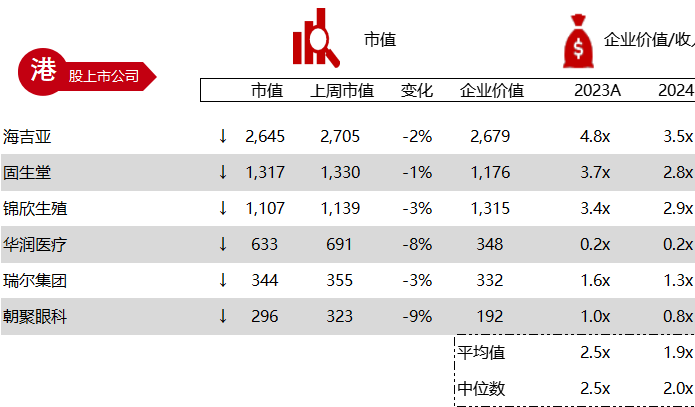
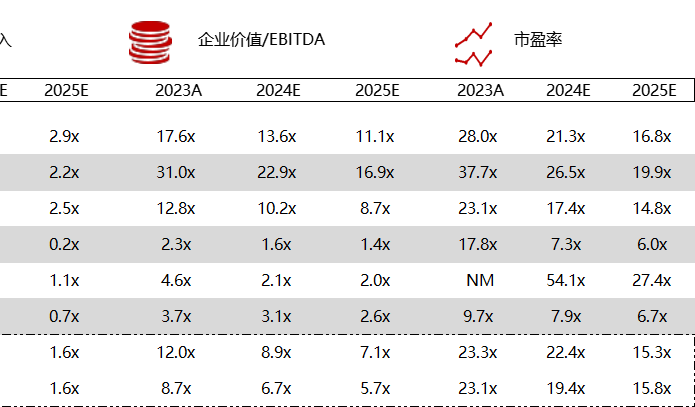
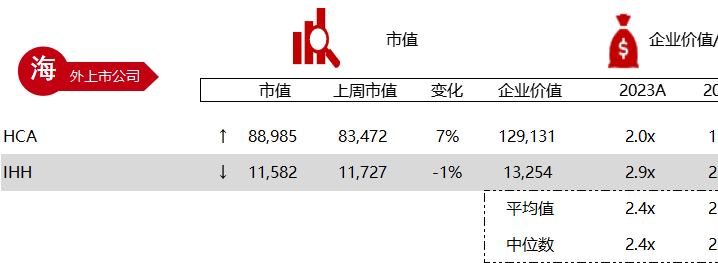
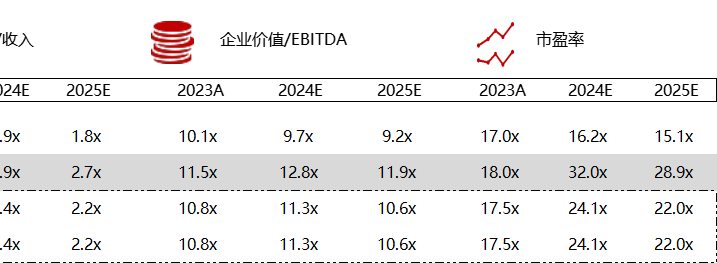
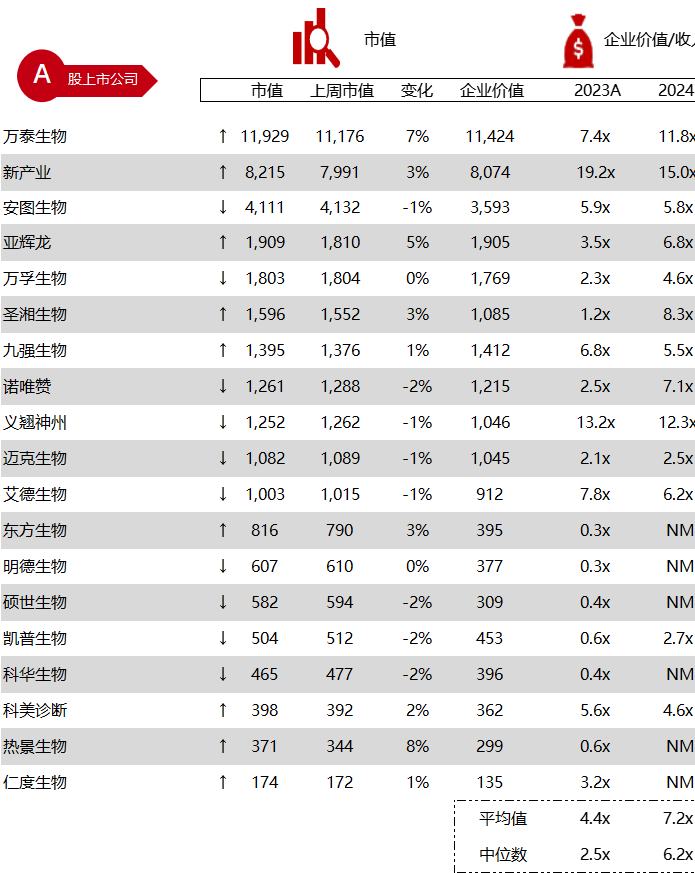
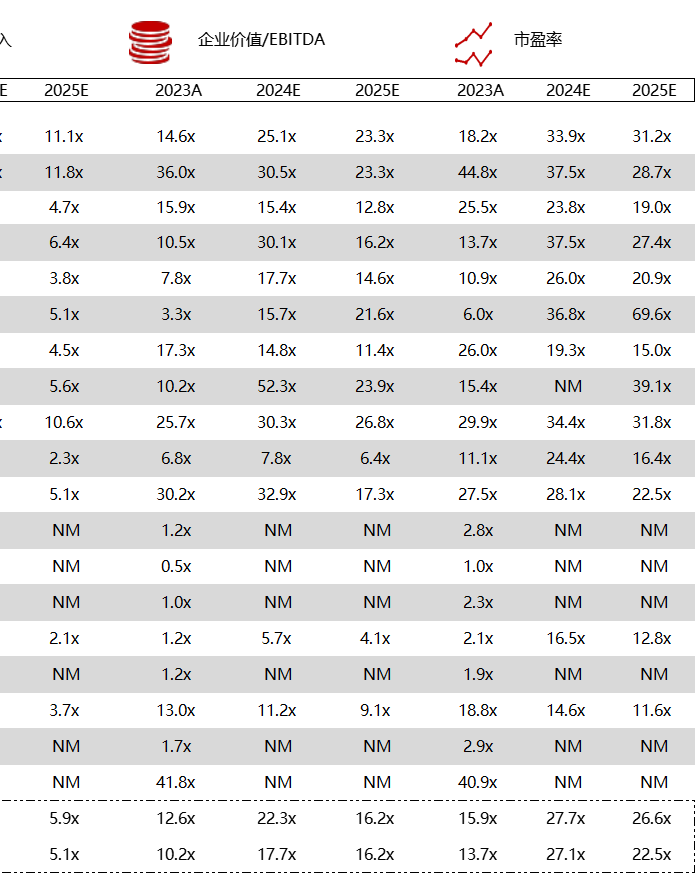
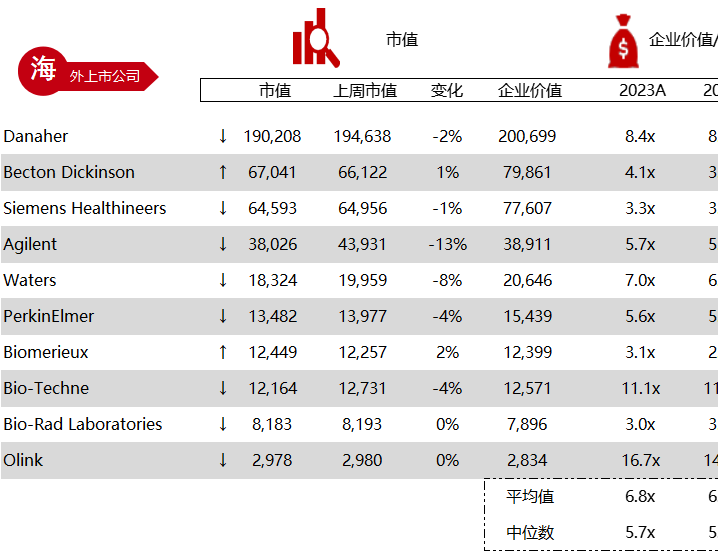
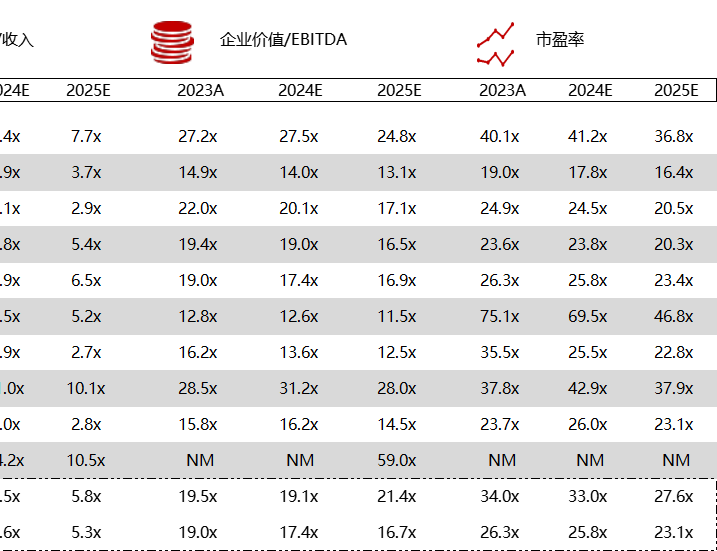
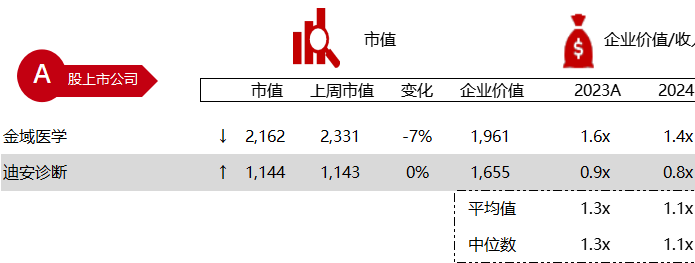
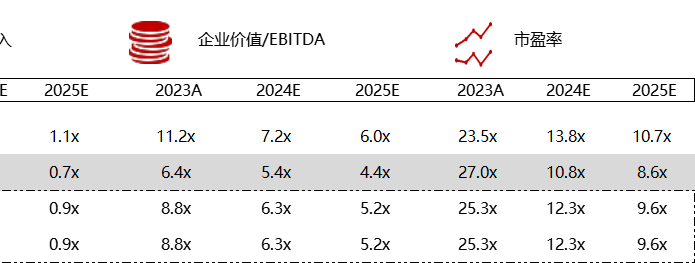
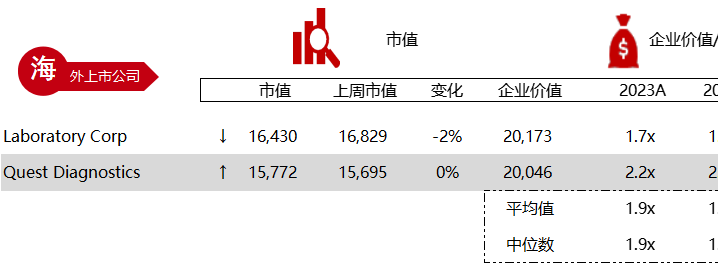
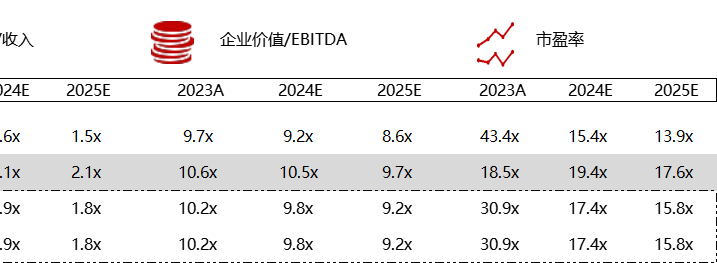
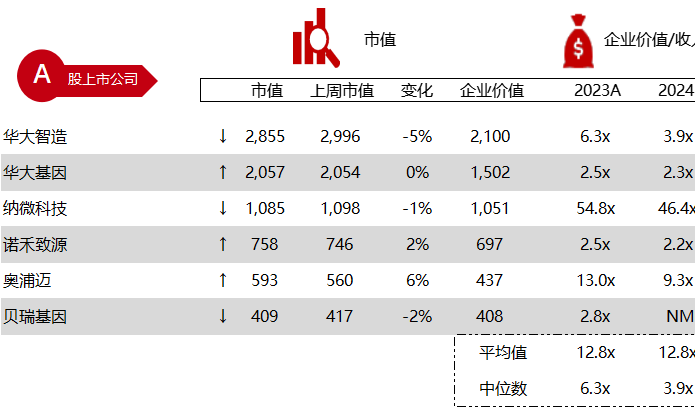
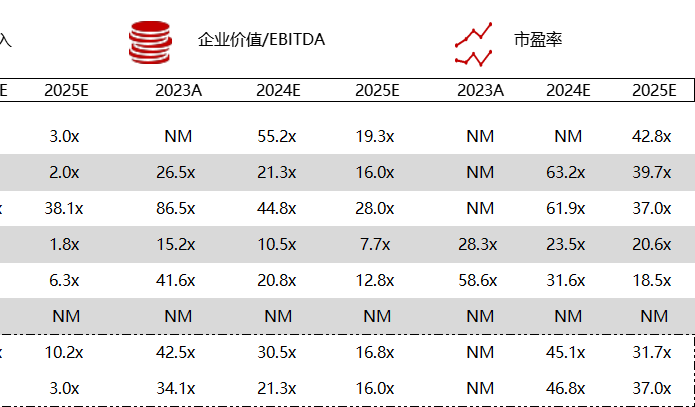
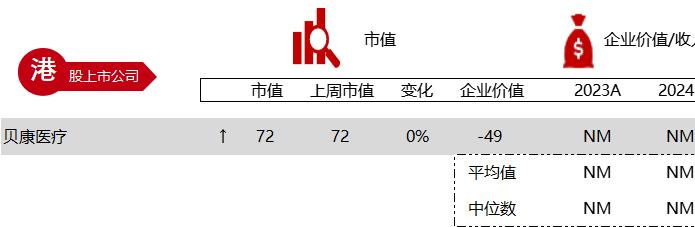
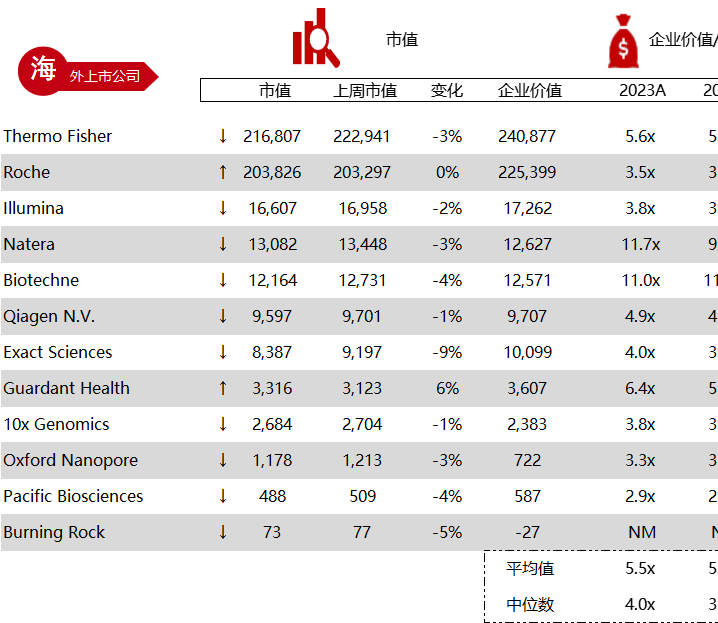
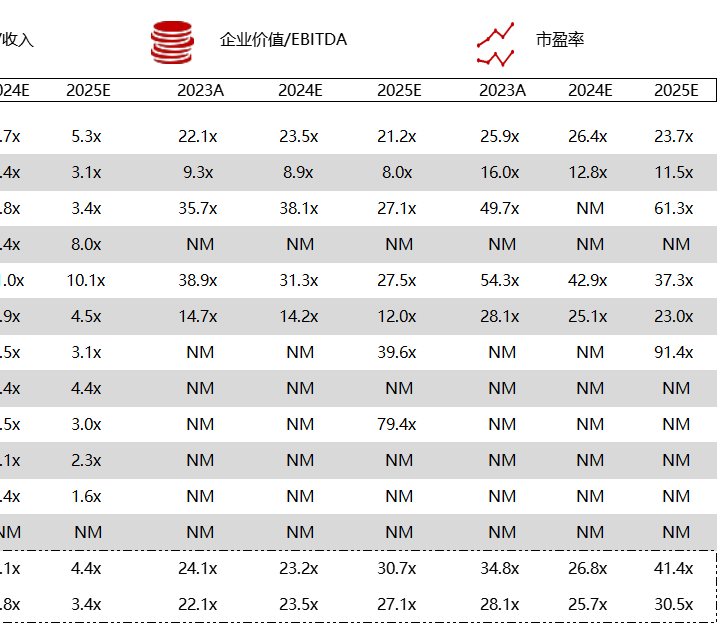
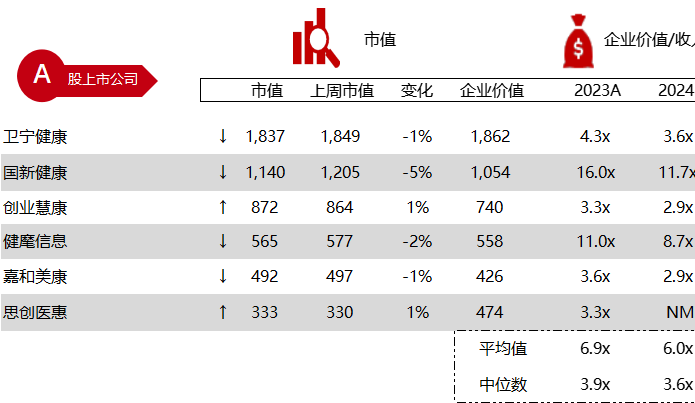
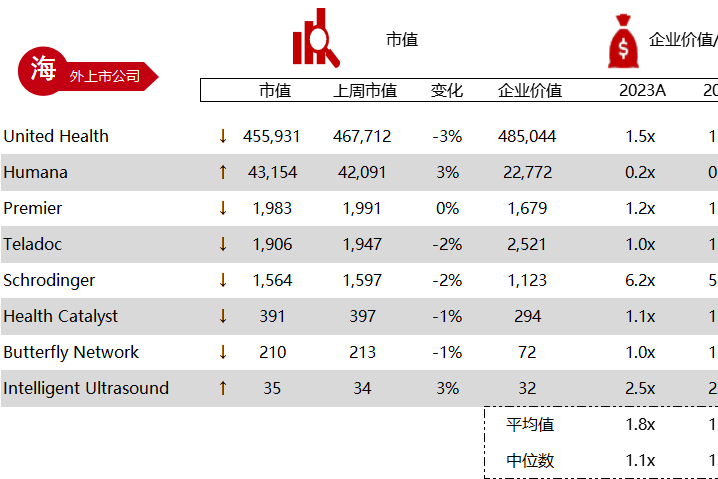
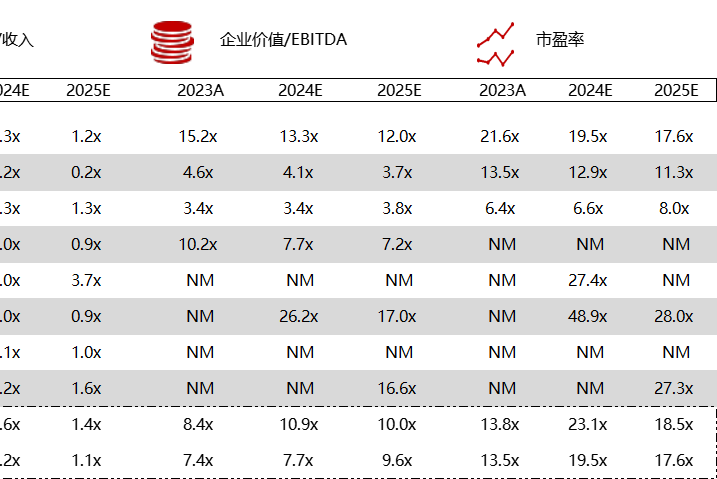
统计区间:2024年5月27日-5月31日
*数据来源:华兴资本内部整理
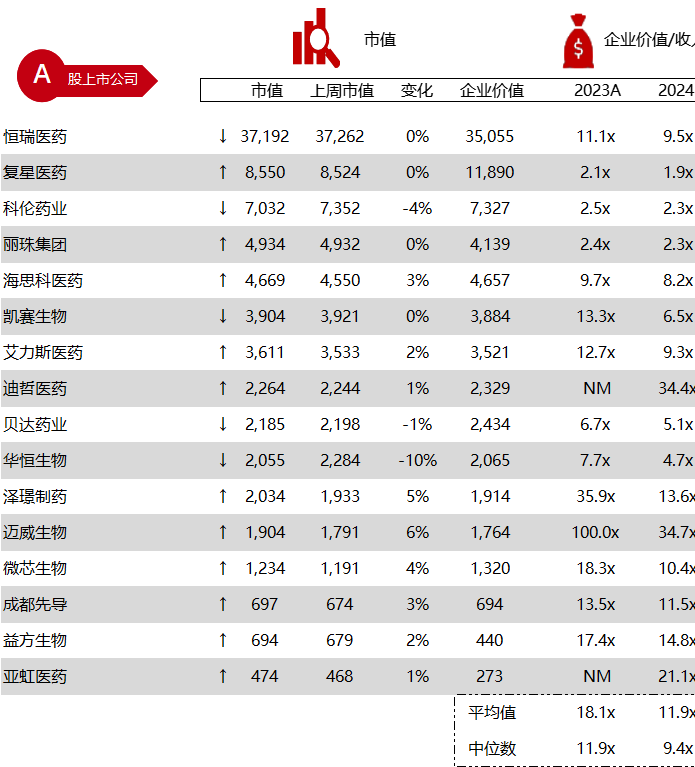
市值日期:2024年5月31日
市值单位:百万美元
< < 左右滑动图片查看完整表格 > >
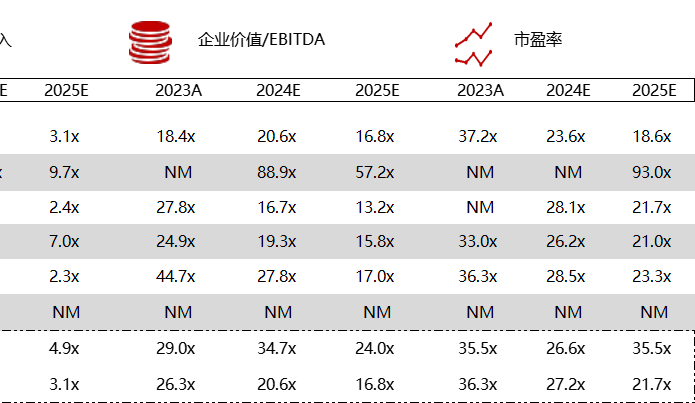
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
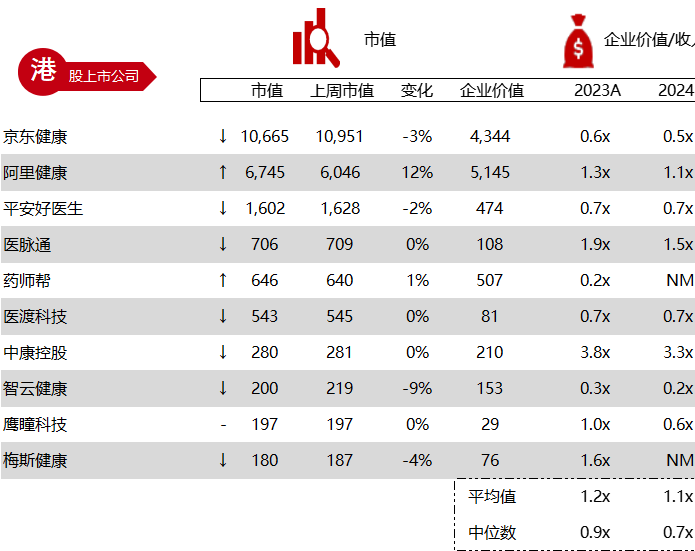
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
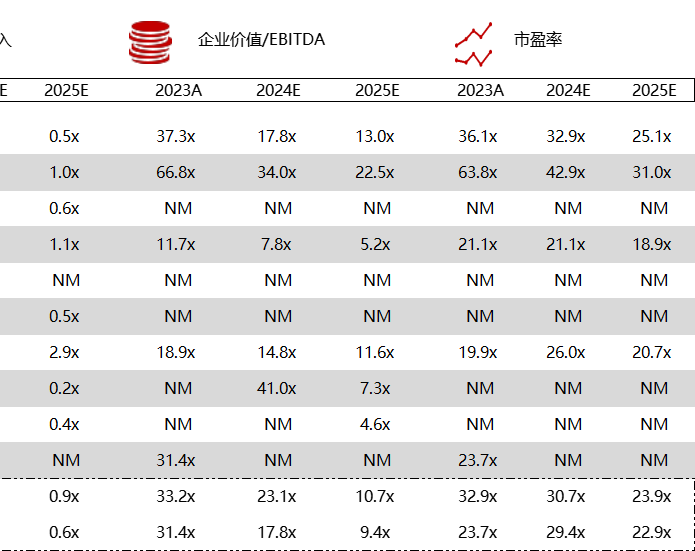
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
*数据来源:Capital IQ、招股说明书、研报、公司年报
免责声明:本文由华兴资本集团(连同其关联公司,统称“华兴资本”)编写,谨供接收方作参考用途,并非作为也不应被视为在任何地区对任何证券的研究报告,不构成买卖、认购证券或其它金融工具及产品的邀请或保证。本文所提及的上市公司仅为示例,不代表任何投资分析或投资建议。接收方不应仅依靠本文、而应按照自己的判断作出投资决定,并在作出任何投资行动前,咨询专业意见。
本文所载资料的来源皆被华兴资本认为可靠,但华兴资本概不担保本文所含信息的准确性、完整性或新近度。本文所载的见解、分析、预测、推断和期望均截至本文的发表日期,且可能在未经事先通知的情况下调整。华兴资本与本文所提及的公司之间可能存在或寻求业务关系,因此,接收方请知悉可能存在的影响本文客观性的利益冲突。华兴资本不对因使用本文而承受的直接或间接损失承担任何责任。本文受到版权和资料全面保护。































精彩评论