“华兴资本医疗与生命科技行业周报”定期发布,专注从资本角度解读一周数据,并提供最新行业观察。
医疗与生命科技是华兴资本多年来关注并深耕的领域,目前已为近200个融资及并购项目担任财务顾问。
医疗与生命科技行业创新不断涌现,已经发展成为最活跃的行业之一,华兴资本始终支持、陪伴这一领域创业企业成长,致力为行业带来理性专业的声音。
作者 | 华兴资本医疗与生命科技团队
关注华兴资本微信公众号(ID:iChinaRenaissance),后台点击“兴观点”-“行业观察”-“生命科技”,获取更多医疗与生命科技行业相关信息。
中博瑞康完成近亿元B轮融资
国内优质细胞制备智能工具系统化整体解决方案服务商——中博瑞康(上海)生物技术有限公司于近日完成近亿元人民币B轮融资。本轮融资由道彤投资领投,启鲲基金和金觉投资跟投,老股东高科新浚、远翼投资及创新工场持续加码。所筹资金将主要用于建设现代化生产体系、全线增强研发实力和全球注册证能力,高速拓展全球关键市场。
行业视角:
中博瑞康不仅仅是一家设备的研发与制造商,更是提供创新综合解决方案的技术服务专家,拥有生产GMP级别的耗材和液体产品的能力,以及相应的产品权威机构认证的注册能力。这使得中博瑞康可以提供涵盖设备、耗材以及液体试剂产品的一站式综合解决方案,为生物创新型制药企业提供卓越的全封闭细胞制备工具解决方案,助力中国在细胞与基因治疗领域的高质量发展。
泰楚生物完成A+轮融资
上海泰楚生物技术有限公司完成A+轮融资,融资额未披露,参与投资的机构包括泰煜投资,观由资本,孚腾资本,钜科投资,泰鲲基金。
行业视角:
泰楚生物是一家领衔新药非临床研究到CDMO生产的企业,可为各类新药研发和生产提供量身定制的单一及组合业务板块的CRO+CDMO技术服务。泰楚生物旗下有四家子公司:泰槿生物、泰澧生物、泰禛生物及泰霁生物,专注于不同专业领域,提供生物医药非临床成药性评价(CRO)、抗体药物发现(CRO)、抗体药物工艺开发和生产(CDMO)、高端制剂递送系统开发及生产(CDMO)、小核酸工艺开发及生产(CDMO)等服务。
博致生物完成1800万美元A轮融资
近日,博致生物 (Proviva Therapeutics)欣然宣布完成1800万美元的A轮融资,以推进其核心产品PTX-912的临床开发。龙磐投资,恩然创投和仙瞳资本联合参加本轮融资。
行业视角:
博致生物是一家临床阶段的生物科技公司,致力于开发新一代细胞因子抗肿瘤免疫疗法。针对细胞因子外周毒性的传统难题,公司自主开发了“Crossover”细胞因子前药技术平台,实现在肿瘤微环境中特异性的药物活性释放。
科润生物完成A+轮融资
3月5日消息,科润生物完成数千万元A+轮融资。本轮融资由智睿投资领投,所募集资金将主要用于科润生物眼科及肿瘤管线产品的临床研究,推动公司产品快速走向产业化和商业化。根据科润生物新闻稿,该公司近两年内共完成上亿元的融资。
行业视角:
科润生物专注于重组蛋白药物开发,公司创始人为李树刚博士。该公司产品管线聚焦眼科、肿瘤领域的生物大分子药物研发。
微光医疗完成超亿元战略轮融资
2024年3月,深圳市中科微光医疗器械技术有限公司获得超亿元的战略投资,此轮融资由华睿投资、广州产投资本、追光硬科技共同投资。本轮融资将用于激光医疗领域新产品的持续开发、临床注册及海外市场的进一步拓展。
行业视角:
微光医疗致力于打造领先的激光医疗创新平台。公司是国内激光医学领域的开拓者和创新领军企业。核心团队来自于清华大学、中国科学院、华西医学院等著名院校,专注于激光医疗领域的领先技术创新、产品自主研发及自主生产。微光医疗是业内为数不多同时掌握软件、硬件及耗材研发能力的企业,也是业内稀缺的自主研发核心部件国产厂商。产品销售额年复合增长率超过80%,其核心产品冠脉OCT实现了国产厂商市场占有率第一。公司注重诊断与治疗的双重发展,运用领先的光电技术,秉承医工结合理念,已围绕冠脉、外周、神经三大核心医疗领域,布局了数个激光医疗创新产品。
途深智合连续完成种子轮及天使轮融资
近日,AI蛋白质设计公司途深智合连续完成种子轮及天使轮融资,两轮投资方分别为光子芯谷、诚美资本。
行业视角:
途深智合致力于打造高效通用的AI蛋白质设计平台,加速生物科技领域产品的研发。公司基于其团队技术背景和对市场的深刻理解,开发了集多种先进自研AI模型的蛋白质设计平台 — ProteinEngine,并不断持续迭代。该平台能够完整覆盖蛋白质设计的全流程,实现蛋白质改造与从头设计。ProteinEngine的推出大幅加快酶改造和全新蛋白序列设计过程,并已在食品、医药、化工和医美等多个生物经济领域得到广泛应用,显著提高了众多工业酶、食品添加剂、医药蛋白的活性、产率和功能。
诺善科技完成千万元天使轮融资
北京诺善科技有限公司完成千万元人民币天使轮融资。本轮融资由无限基金SEE FUND独家投资,资金将用于公司全功能微流控类器官芯片的临床前研究。
行业视角;
诺善科技成立于2024年1月,核心团队和技术来自北京理工大学及北京协和医院。诺善科技团队长期深耕微流控芯片及其在临床医学领域的应用研究,具备国内领先的复杂全功能微流控芯片研制能力。在国家重点研发计划等多项国家级科研项目的支持下,团队专注开发用于肺癌药敏测试的全功能微流控芯片,目前已完成芯片原型开发,并在北京协和医院开展了国内首个基于微流控芯片的癌症药敏测试前瞻性临床队列研究。
全球血液科技巨头唯美血液Haemonetics收购食管保护设备制造商Attune Medical
2024年3月5日,全球血液科技巨头唯美血液Haemonetics(纽约证券交易所股票代码:HAE)宣布对食管保护设备制造商Attune Medical的收购已达成最终协议,预计将花费至少1.6亿美元(约11.5亿人民币)。
行业视角:
Attune Medical旗下主要有食管主动冷却装置ensoETM,这是目前FDA批准的唯一一款用于在射频心脏消融手术期间保护食管的温度调节装置。
布鲁克Bruker收购体外诊断系统提供商ELITechGroup
布鲁克Bruker签署收购协议,将以9.42亿美元(折合人民币约为67.7亿元)的价格收购体外诊断系统提供商ELITechGroup。据悉,该交易并不包括ELITech的临床化学业务,预计将于2024年第二季度结束。此外,交易完成后,ELITech预计将成为Bruker微生物学和感染诊断业务的一个独立业务,成为布鲁克生命科学和质谱业务所在的CALID集团的一部分。
行业视角;
ELITechGroup是一家综合体外诊断公司,总部位于法国普托,通过直销组织和第三方分销合作伙伴,为超过100个国家的医院和诊断实验室提供服务。该公司开发、制造并销售广泛的诊断产品和解决方案——包括仪器、试剂和软件。拥有超过650名员工。
国务院常务会议审议通过《推动大规模设备更新和消费品以旧换新行动方案》
近日,国务院总理主持召开国务院常务会议,审议通过《推动大规模设备更新和消费品以旧换新行动方案》。
百济神州“泽布替尼”新适应症获FDA加速批准
司美格鲁肽再获FDA批准
创新眼科产品获FDA批准上市,远大医药拥有中国大陆等地区权益
勃林格殷格翰“佩索利单抗”皮下注射制剂在华获批上市
复宏汉霖“曲妥珠单抗”生物类似药在菲律宾、泰国获批上市
FDA批准创新眼药水疗法
多款医疗器械产品获批上市
百济神州“泽布替尼”新适应症获FDA加速批准
3月8日,百济神州宣布百悦泽(泽布替尼)获美国FDA加速批准,用于联合抗CD20单克隆抗体奥妥珠单抗,治疗既往经过至少二线系统治疗的复发或难治性(R/R)滤泡性淋巴瘤(FL)成人患者。根据百济神州新闻稿,该项适应症的加速批准是基于总缓解率(ORR)和缓解持续时间(DOR),此次批准也标志着泽布替尼在美国获批第5项B细胞恶性肿瘤适应症。
信息来源:药明康德
司美格鲁肽再获FDA批准
美国FDA批准了诺和诺德(Novo Nordisk)减重疗法Wegovy(semaglutide,司美格鲁肽)注射液的新适应症,用于降低患有心血管疾病和肥胖或超重的成人心血管死亡、心脏病发作和中风的风险。司美格鲁肽应与低热量饮食和增加锻炼活动相结合使用。根据FDA新闻稿,司美格鲁肽为获批用于辅助患有心血管疾病及肥胖或超重的成年人预防重大心血管事件的首款减重药物。
信息来源:药明康德
创新眼科产品获FDA批准上市,远大医药拥有中国大陆等地区权益
3月7日消息,远大医药宣布其两款创新眼科产品取得重要进展。其中,激素纳米混悬滴眼液GPN00833(APP13007)的新药上市申请(NDA)正式获得美国FDA批准用于眼科术后抗炎镇痛,远大医药拥有该产品在中国大陆、香港和澳门地区的独家开发和商业化权利。另一款创新眼科药物GPN00884的新药临床试验申请(IND)获中国NMPA正式批准,用于延缓儿童近视进展。
信息来源:医药观澜
勃林格殷格翰“佩索利单抗”皮下注射制剂在华获批上市
3月6日,勃林格殷格翰宣布,其罕见皮肤病创新靶向生物制剂佩索利单抗(商品名:圣利卓)皮下注射制剂上市申请已获国家药监局批准,用于减少12岁及以上青少年(体重≥40kg)和成人的泛发性脓疱型银屑病(GPP)发作。
信息来源::医药魔方
复宏汉霖“曲妥珠单抗”生物类似药在菲律宾、泰国获批上市
3月6日,复宏汉霖宣布,近期该公司按照中国、欧盟和美国等生物类似药法规自主研发的曲妥珠单抗生物类似药接连在泰国和菲律宾获批上市,用于HER2阳性乳腺癌和胃癌的治疗。截至目前,该产品已在全球超过40个国家和地区获批上市。
信息来源:医药观澜
FDA批准创新眼药水疗法
日前,Formosa Pharmaceuticals和AimMax Therapeutics宣布,美国FDA已批准0.05%丙酸氯倍他索(clobetasol propionate)眼科悬液(APP13007)上市,用于治疗眼科手术后的炎症和疼痛。新闻稿指出,这是FDA批准的首个丙酸氯倍他索眼科产品,也是15年来眼科市场上的首个新型类固醇疗法,为患者提供了方便直接的给药方案。
信息来源:药明康德
多款医疗器械产品获批上市
2024年3月6日,全球糖尿病械企巨头Dexcom宣布,其开发的“Stelo连续血糖监测仪”获得FDA批准在美上市。这也是FDA批准的首款非处方(OTC)连续血糖监测设备。
信息来源:器械之家
由成都集思鸣智科技有限公司自主研发的“大脑生理与认知功能辅助评估系统”获批NMPA医疗器械注册证,产品具备对大脑生理与认知功能进行评估和对轻度认知功能障碍(MCI)进行客观早期辅助诊断的能力,为认知功能障碍的早筛和辅助诊断提供便捷的医疗设备。
信息来源:动脉网
大洲医学旗下全球首款3D打印仿骨结构钽金属骨填充重建棒(坦瑞生®)获NMPA三类医疗器械注册证。
信息来源:动脉网
美敦力宣布,其 OsteoCool 2.0 骨肿瘤消融系统获得美国食品及药物管理局(FDA)许可,用于治疗疼痛性骨转移和良性骨肿瘤,例如如骨样骨瘤。
信息来源:思宇MedTech
近日,深睿医疗颅内动脉瘤CT造影图像辅助检测软件通过创新通道获批NMPA三类证。
信息来源:医疗器械创新网
Volta Medical 宣布其 Volta AF-Xplorer 获得 CE 标志,这是一种人工智能 (AI)驱动的系统,已在美国获得FDA批准
信息来源:CCI心血管医生创新俱乐部
博安生物“度拉糖肽”生物类似药完成3期临床
艾威药业新机制干眼新药在美国获批临床
再生元“siRNA+C5补体抑制剂”组合疗法在华获批临床
箕星药业公布干眼疗法中国3期临床数据
GSK癌症ADC疗法达3期达主要终点
强生创新三特异性抗体疗法在华获批临床
Exonate潜在“first-in-class”眼药水临床结果积极
齐鲁制药公布PD-1/CTLA-4靶向组合抗体2期临床数据
博安生物“度拉糖肽”生物类似药完成3期临床
3月8日,博安生物宣布,其自主开发的度拉糖肽注射液生物类似药(BA5101)已在中国完成3期临床试验(临床有效性比对研究),计划递交上市申请。BA5101拟用于成人2型糖尿病患者的血糖控制。
信息来源:医药观澜
艾威药业新机制干眼新药在美国获批临床
3月8日,艾威药业(IVIEW Therapeutics)宣布,FDA通过了该公司1类新药IVW-1001治疗干眼的临床IND申请。该试验将评估一种TRPM8激动剂IVW-1001在治疗干眼的体征和症状方面的安全性、耐受性和有效性。艾威药业预计将在2024年第二季度启动在美国的1/2期临床试验。
信息来源:医药观澜
再生元“siRNA+C5补体抑制剂”组合疗法在华获批临床
3月8日,中国国家药监局药品审评中心(CDE)官网公示,再生元(Regeneron)申报的cemdisiran注射液与pozelimab注射液的联合疗法获批临床,用于治疗伴有活动性体征和溶血迹象的阵发性夜间血红蛋白尿(PNH)成年男性和女性患者。公开资料显示,cemdisiran是一种皮下注射、靶向C5补体的小干扰RNA(siRNA)疗法药物,pozelimab是一款新一代C5补体抑制剂。
信息来源:医药观澜
箕星药业公布干眼疗法中国3期临床数据
3月8日,箕星药业宣布酒石酸伐尼克兰鼻喷雾剂治疗中国干眼人群的3期临床试验研究结果在国际期刊《柳叶刀》(The Lancet)的子刊The Lancet Regional Health – Western Pacific发表。伐尼克兰鼻喷雾剂是箕星药业引进的一种经鼻给药促进天然泪液分泌的创新方式。该产品此前已经在中国申报上市,用于治疗干眼症状和体征。
信息来源:医药观澜
GSK癌症ADC疗法达3期达主要终点
SK宣布了DREAMM-8临床3期头对头试验的中期分析结果,该试验评估其抗体偶联药物(ADC)Blenrep(belantamab mafodotin)联合pomalidomide加地塞米松(PomDex)与标准治疗硼替佐米(bortezomib)加PomDex,作为复发性或难治性多发性骨髓瘤的二线和后期疗法的疗效与安全性。分析显示,该试验达到无进展生存期(PFS)的主要终点,并根据独立数据监测委员会(IDMC)的建议提前揭盲。GSK将与监管机构讨论这些数据。
信息来源:药明康德
强生创新三特异性抗体疗法在华获批临床
中国国家药监局药品审评中心(CDE)官网公示,强生(Johnson & Johnson)旗下强生创新制药(Johnson & Johnson Innovative Medicine)1类新药JNJ-80948543注射液获批临床,拟开发治疗淋巴细胞恶性肿瘤。公开资料显示,这是一款新型CD79b x CD20 x CD3三特异性T细胞重定向抗体。
信息来源:医药观澜
Exonate潜在“first-in-class”眼药水临床结果积极
Exonate宣布其主打候选药物EXN407在1b/2a期临床试验中获得积极结果。数据显示了EXN407的安全性和耐受性,以及明显的生物活性信号。这些数据支持进一步开发EXN407成为治疗糖尿病视网膜病和糖尿病性黄斑水肿等视网膜血管疾病的首个外用治疗方法。Exonate计划将EXN407推进到2b期临床试验。
信息来源:药明康德
齐鲁制药公布PD-1/CTLA-4靶向组合抗体2期临床数据
近日,齐鲁制药宣布,在2024年欧洲妇科肿瘤学会(ESGO)年会上,该公司将以口头报告形式公布其1类新药艾帕洛利托沃瑞利单抗注射液(QL1706)治疗宫颈癌的2期临床试验研究结果。具体报告时间为欧洲当地时间3月8日。艾帕洛利托沃瑞利单抗是一种PD-1/CTLA-4靶向组合抗体,其针对宫颈癌的上市申请已于2023年8月获得中国国家药监局药品审评中心(CDE)受理。
信息来源:医药观澜
开发肿瘤靶向三特异性抗体,吉利德超15亿美元达成合作
长星生物与楷拓生物合作,共同开发体内CAR-T疗法
超7亿美元开发抗癌蛋白降解疗法,德国默克达成合作
拜耳囊获创新小分子药物权益
开发肿瘤靶向三特异性抗体,吉利德超15亿美元达成合作
吉利德科学公司(Gilead Sciences)和Merus宣布达成一项研究合作和许可协议,将共同开发靶向新型肿瘤相关抗原(TAA)的三特异性抗体。根据协议条款,Merus将领导两个项目的早期研究活动,并可选择开展第三个项目。在完成选定的研究活动后,吉利德将有权利获得合作开发项目的许可权。如果吉利德自合作项目中行使其选择权,吉利德将负责此类项目的额外研究、开发和商业化活动。Merus将收到5600万美元预付款,以及吉利德对Merus的2500万美元投资。在所有潜在项目中,Merus还有资格获得高达15亿美元的款项,包括潜在的开发和商业化里程碑付款等。
信息来源:药明康德
长星生物与楷拓生物合作,共同开发体内CAR-T疗法
近日,湖南长星生物医药有限公司与楷拓生物科技(苏州)有限公司宣布正式签署战略合作协议。双方将在全球范围内开展基于非阳离子脂质递送系统的In vivo(体内)CAR-T疗法前沿技术合作,加快推进肿瘤免疫疗法的临床及商业化应用步伐,该技术可大幅降低传统CAR-T细胞疗法的生产成本、缩短生产周期,开辟肿瘤治疗的新纪元。
信息来源:细胞基因治疗前沿
超7亿美元开发抗癌蛋白降解疗法,德国默克达成合作
C4 Therapeutics(C4T)宣布已与德国默克(Merck KGaA)签订一项许可和合作协议,合作开发针对C4T在其内部发现管线中推进的两个关键致癌蛋白靶点的靶向蛋白降解剂。根据协议条款,C4T将收到1600万美元的前期付款。德国默克将资助C4T的发现研究工作。C4T有可能在整个合作中获得高达大约7.4亿美元的发现、监管和商业里程碑付款。
信息来源:药明康德
拜耳囊获创新小分子药物权益
BridgeBio Pharma和拜耳(Bayer)宣布建立合作伙伴关系,BridgeBio授予拜耳在欧洲商业化用于治疗伴有心肌病的转甲状腺素蛋白介导的淀粉样变性(ATTR-CM)的在研疗法acoramidis的独家许可。BridgeBio将获得高达3.1亿美元前期付款和近期里程碑等款项。
信息来源:药明康德
国产影像核心部件龙头启动IPO
近日,中国证监会网站最新披露,X光设备制造商上海超群检测科技股份有限公司日前在上海证监局进行辅导备案登记,辅导机构为国金证券。
信息来源:器械之家
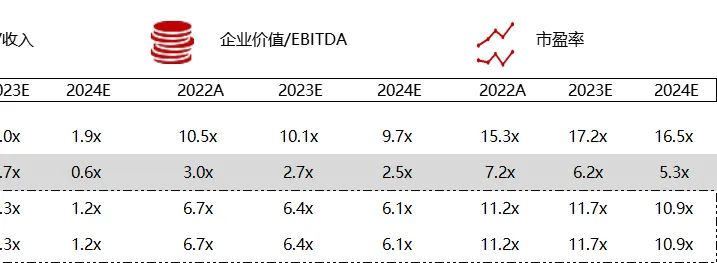
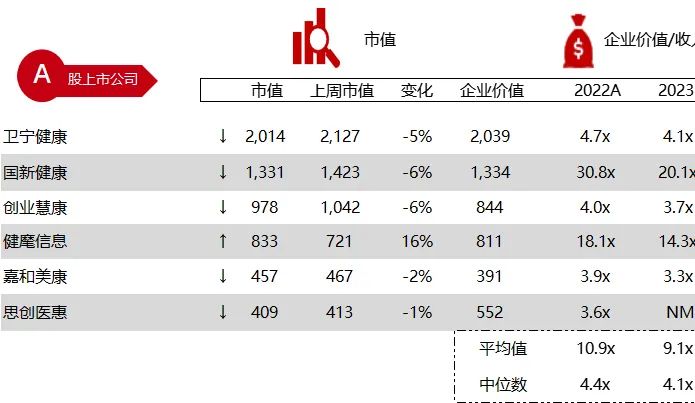
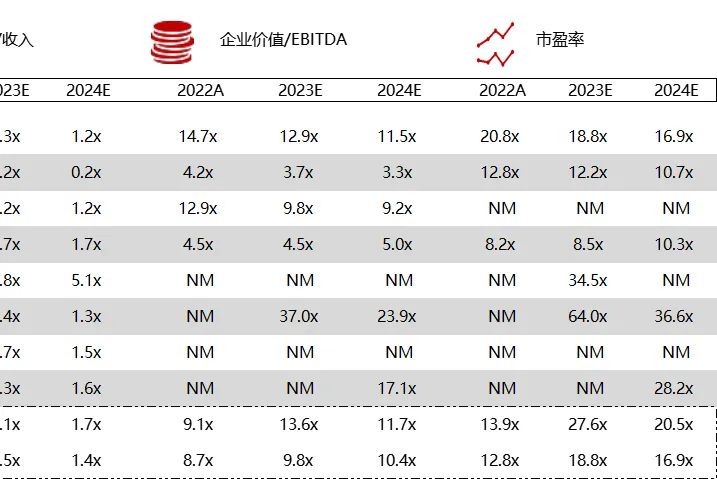
统计区间:2024年3月2日-3月7日
*数据来源:华兴资本内部整理
市值日期:2024年3月8日
市值单位:百万美元
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
*数据来源:Capital IQ、招股说明书、研报、公司年报
免责声明:本文由华兴资本集团(连同其关联公司,统称“华兴资本”)编写,谨供接收方作参考用途,并非作为也不应被视为在任何地区对任何证券的研究报告,不构成买卖、认购证券或其它金融工具及产品的邀请或保证。本文所提及的上市公司仅为示例,不代表任何投资分析或投资建议。接收方不应仅依靠本文、而应按照自己的判断作出投资决定,并在作出任何投资行动前,咨询专业意见。
本文所载资料的来源皆被华兴资本认为可靠,但华兴资本概不担保本文所含信息的准确性、完整性或新近度。本文所载的见解、分析、预测、推断和期望均截至本文的发表日期,且可能在未经事先通知的情况下调整。华兴资本与本文所提及的公司之间可能存在或寻求业务关系,因此,接收方请知悉可能存在的影响本文客观性的利益冲突。华兴资本不对因使用本文而承受的直接或间接损失承担任何责任。本文受到版权和资料全面保护。










































































精彩评论