“华兴资本医疗与生命科技行业周报”定期发布,专注从资本角度解读一周数据,并提供最新行业观察。
医疗与生命科技是华兴资本多年来关注并深耕的领域,目前已为近200个融资及并购项目担任财务顾问。
医疗与生命科技行业创新不断涌现,已经发展成为最活跃的行业之一,华兴资本始终支持、陪伴这一领域创业企业成长,致力为行业带来理性专业的声音。
作者 | 华兴资本医疗与生命科技团队
关注华兴资本微信公众号(ID:iChinaRenaissance),后台点击“兴观点”-“行业观察”-“生命科技”,获取更多医疗与生命科技行业相关信息。
光声制药完成上亿元A轮融资
上海光声制药有限公司宣布成功完成上亿元人民币A轮融资。本轮融资由东方富海独家投资,融资款项将用于推动该公司在光动力治疗领域新产品研发及首款产品商业化。
行业视角:
光声制药致力于推动光/声动力等激发性治疗方式的发展,主要聚焦创新型光敏剂及其相关产品的研发、生产、商业化。光声制药目前主要产品抗肿瘤光敏剂“注射用华卟啉钠”是化药1类新药。在华卟啉钠注射24h后,它可在肿瘤组织蓄积,维持局部高暴露量,是一种组织选择性高、药物活性高、皮肤毒性低的具有差异化优势的新型光敏剂。根据已有的临床前和1、2期临床研究结果显示,与传统有效成分不明确的光敏剂相比,华卟啉钠疗效和安全性大幅提升。目前华卟啉钠首个3期注册临床研究患者入组已进入尾声,将有望于近年内以晚期食管癌适应症获批上市。
安济盛生物宣布完成4000万美元B+轮第二阶段融资
安济盛生物,一家专注于骨骼、关节和肌肉重症疾病领域的创新药物研发公司宣布,已于2024年1月完成由广州高新科控主要出资、粤开资本市场化管理基金——粤凯医健领投的B+轮第二阶段4000万美元融资。叠加2023年10月已完成的B+轮4600万美元融资,安济盛生物在B+轮融资中共筹集8600万美元。本轮融资将用于推进安济盛生物对治疗严重肌肉骨骼疾病的创新候选药物(包括AGA2118、AGA2115和AGA111)的全球开发。
行业视角:
安济盛生物是一家专注于骨骼、关节和肌肉重症疾病领域的新药研发公司。公司以对骨骼肌肉系统疾病致病机制的科学洞见和在创新药物开发上积累的丰富成功经验,致力为患者带来优效和安全的全新治疗方案。
烁星生物完成数千万元融资
近日,北京烁星生物医药科技有限公司宣布完成数千万元人民币A+轮融资。本轮融资由珠海科创投、珠海高新金投和广大汇通联合投资。
行业视角:
烁星生物是一家创新驱动型生物制药公司,致力于创新药物的发现和开发;以自有VHH多抗生物药平台技术为基础,聚焦突破当前缺乏治疗方案的适应症,开发全球同类首个(First-in-Class)与同类最优(Best-in-Class)的创新多功能抗体药物,以及在全球范围内的临床研发及商业化。
鲲石生物完成数千万元Pre-A轮融资
2024年2月,专注于巨噬细胞药物治疗实体瘤的鲲石生物完成Pre-A轮数千万元人民币融资,本轮融资由融汇集团旗下管理公司国铸资本领投,得时资本持续追加投资。本轮融资主要用于临床管线RR-M01的IND申报以及青岛鲲石生物递送载体生产基地的建设。
行业视角:
鲲石生物是一家专注于靶向实体瘤巨噬细胞药物研发生产的生物公司,着力推动巨噬细胞药物在靶向实体瘤领域的产业化发展。公司多管线布局,聚焦于实体肿瘤治疗领域,适应症覆盖了90%的实体瘤,其中先发管线RR-M01,是针对HER2阳性的实体瘤自主研发的一款第三代嵌合抗原受体巨噬细胞药物,其适应症包括HER2阳性的卵巢癌、胃癌、乳腺癌、宫颈癌、子宫内膜癌、肺癌及胰腺癌等复发、难治性实体瘤。
先声再明获9.7亿元融资
2月25日,先声药业发布公告称,其子公司先声再明获得9.7亿元融资。本轮融资由先进制造领投,中深新创、杏泽兴涌、鼎信中和跟投,融资资金将用于先声再明主要业务范围内的产品研发、生产及营运。
行业视角:
先声药业是一家创新与研发驱动的制药公司,聚焦肿瘤、神经系统、自身免疫和抗感染领域。先声再明是先声药业的附属公司,主要专注于抗肿瘤领域药品的研发、生产及销售。在研发策略上,先声再明重点关注肺癌、胃肠道癌、妇科癌症等疾病领域。目前,先声再明的产品管线包含了30多个研发项目,涵盖创新单克隆抗体、双/多特异性抗体、抗体偶联药物(ADC)、小分子药物等多种类型。
艾迪迈完成近五千万元Pre-A轮融资
近日,南京艾迪迈科技有限公司宣布继动平衡资本、南京市创新投资集团之后,又完成由宇杉资本、苏州天汇微球基金、中鑫资本的近五千万元Pre-A轮融资。本轮融资资金将主要用于生命科学领域自动化检测与纯化整体解决方案的落地,加速临床小分子检测与纳微&艾迪迈CRDMO解决方案等开发及推广,为临床色谱质谱实验室、生物分析实验室、药物检测实验室等实现智能化自动化赋能。
行业视角:
艾迪迈以原研技术驱动产品创新为战略核心,拥有智能化核心材料制备技术及自动化辅助设备开发应用与GMP生产能力,在多地设立有技术应用与服务中心,与中国科学院、威高集团、日本岛津、纳微生命等知名院校和企业建立长期合作,是国内领先的专用型色谱、质谱自动化检测领域的材料、设备及应用的全流程解决方案供货商。
明度智云完成数亿元C轮融资
生命科学领域数字化转型服务商明度智云(浙江)科技有限公司正式宣布完成数亿元C轮融资,本轮融资由深创投领投、招商健康追加投资。
行业视角;
明度智云是国内领先的生命科学领域数字化转型服务商,以医药工业4.0时代的研发与制造为基石,构建了“数字实验室”和“数字工厂”相互协同的数智科技平台,助力药企在数字化研发、生产、未来工厂、质量管控等方向全面数字化转型。
盾恩医学完成数千万元A+轮融资
杭州盾恩医学检验实验室有限公司于近日宣布完成数千万元A+轮融资。本轮融资由晶耀基金领投,其他国内知名基金跟投。融资资金将用于盾恩医学在精准用药相关产品和试剂的研发、科研服务能力的持续加强以及共建实验室的进一步市场拓展。
行业视角:
盾恩医学是浙江清华长三角研究院“临床精准用药研究中心”的联建单位,同时也是浙江长三角生物医药研究发展中心的技术支持与成果转化单位。公司聚焦精准药学服务,拥有临床个性化用药基因分析平台、药物浓度监测理化平台、药物毒理作用研究平台以及人工智能处方辅助系统等多个平台,并围绕精准药物治疗展开临床检测服务、检测设备和试剂盒等产品销售。
泰格捷通收购医疗器械CRO国际巨头中国区分公司
2024年2月29日,泰珑投资旗下泰鲲基金已投项目泰格捷通宣布对全球知名医疗技术CRO NAMSA中国区分公司-能盛(上海)医疗器械科技咨询有限公司的收购,并与NAMSA签署战略合作协议,达成与NAMSA在中国区域的独家合作及全球合作。
行业视角;
NAMSA中国作为NAMSA全球布局的重要区域业务板块,为医疗器械研发企业提供全球端到端的研发服务,包括医疗器械咨询、法规事务、质量咨询、及临床研究等,在心血管、口腔、眼科及IVD等多个治疗领域拥有专业能力和丰富经验。
美国第三方医疗设备维保行业龙头Agiliti被大股东收购
2月26日,美国第三方医疗设备维保行业龙头Agiliti宣布,在纽交所上市三年后,公司与其大股东、收购之王——Thomas H. Lee Partners(THL)达成了合并协议,后者的子公司将以25亿美元(约合人民币180亿)的总对价收购Agiliti股份,交易完成后Agiliti将退市,成为一家私有化公司。
行业视角:
Agiliti拥有八十多年的历史,服务于全美10,000多家医疗机构,市场占有率超过20%。最新财显示Agiliti在2023年第三季度亏损1270万美元,而去年同期的净收入为200万美元。第三季度收入增长7.5%,达到2.916亿美元。
国家药监局正式发布20项医疗器械行业标准
国家药监局关于发布YY 1001—2024《全玻璃注射器》等20项医疗器械行业标准的公告。
强生双特异性抗体联合疗法获FDA完全批准
科济药业BCMA CAR-T产品在中国获批上市
吉利德HIV复方新药Biktarvy获FDA批准扩展适应症
Teva/Alvotech阿达木单抗可互换生物类似药获FDA批准上市
多款医疗器械产品获批上市
强生双特异性抗体联合疗法获FDA完全批准
强生(Johnson & Johnson)宣布美国FDA完全批准其双特异性抗体Rybrevant(amivantamab)联合化疗(卡铂和培美曲塞)用于一线治疗局部晚期或转移性非小细胞肺癌(NSCLC)患者,这些患者的肿瘤经美国FDA批准的测试确认带有表皮生长因子受体(EGFR)外显子20插入突变。Rybrevant联合化疗是FDA批准用于治疗这类患者群体的首款疗法。
信息来源:药明康德
科济药业BCMA CAR-T产品在中国获批上市
3月1日,科济药业(股票代码:2171.HK)发布公告:国家药品监督管理局已批准其BCMA CAR-T产品赛恺泽®(泽沃基奥仑赛注射液)新药上市申请,用于治疗复发或难治性多发性骨髓瘤成人患者,既往经过至少3线治疗后进展(至少使用过一种蛋白酶体抑制剂及免疫调节剂)。
信息来源:细胞基因治疗前沿
吉利德HIV复方新药Biktarvy获FDA批准扩展适应症
2月26日,吉利德宣布,美国FDA批准Biktarvy(比克替拉韦50mg/恩曲他滨 200mg /替诺福韦艾拉酚胺 25mg片剂,B/F/TAF)一项新适应症,用于治疗病毒载量受到抑制且已知或疑似具有M184V/I耐药性的HIV感染者(PWH)。艾滋病毒治疗耐药性是永久性和不可逆转的,这可能危及PWH未来的治疗选择。
信息来源:医药魔方Info
Teva/Alvotech阿达木单抗可互换生物类似药获FDA批准上市
2月24日,Alvotech和Teva Pharmaceuticals宣布,美国FDA已批准Simlandi(adalimumab-ryvk)注射剂作为Humira(阿达木单抗)的可互换生物类似药,用于治疗成人类风湿性关节炎、青少年特发性关节炎、成人银屑病关节炎、成人强直性脊柱炎、克罗恩病、成人溃疡性结肠炎、成人斑块性银屑病、成人化脓性汗腺炎和成人葡萄膜炎。
信息来源:医药魔方Info
多款医疗器械产品获批上市
2024年3月1日,国家药品监督管理局批准了杭州深睿博联科技有限公司 “颅内动脉瘤CT造影图像辅助检测软件” 创新产品注册申请。
信息来源:思宇MedTech
波科宣布其载药球囊---Agent DCB获FDA批准上市,该球囊可用于治疗冠状动脉疾病患者的冠状动脉支架内再狭窄(ISR)。
信息来源:MedTF
强生宣布其首款PFA产品---VARIPULSE获CE批准上市,用于治疗症状性药物难治性复发性发作性房颤。
信息来源:MedTF
上海睿触科技有限公司的穿刺手术机器人,获得国家药品监督管理局(NMPA)上市批准(注册证编号:国械注准20243010387)。
信息来源:思宇MedTech
Virtual Incision宣布其首款便携式单孔机器人---MIRA获FDA批准上市,这是FDA批准全球第一款小型便携式软组织手术机器人,适用于接受结肠切除术的成年人。
信息来源:MedTF
尧唐生物体内基因编辑药物获批临床
加科思P53 Y220C激活剂在美国获批临床
赛诺菲TNFα抑制剂在中国获批临床
来凯医药ActRIIA抗体LAE102临床试验申请获NMPA受理
再鼎医药引进的小分子新药获批临床
阿斯利康CD19 × CD3双特异性疗法在中国获批临床
默沙东联合开发,前列腺癌1类新药在中国启动3期临床
圣因生物siRNA药物在新西兰获批1期临床
尧唐生物体内基因编辑药物获批临床
2024年3月1日,中国上海,尧唐生物宣布,其自主研发的首个体内基因编辑药物YOLT-201的临床试验申请(IND)已获得中国国家药品管理局药品审评中心(CDE)批准,标志着该候选药物正式全面进入注册临床开发阶段。
信息来源:细胞基因治疗前沿
加科思P53 Y220C激活剂在美国获批临床
3月1日,加科思宣布其自主研发的P53 Y220C激活剂JAB-30300在美国获批新药临床试验申请(IND),将在美国开展针对晚期实体瘤的1/2a期临床试验,以评估该产品的安全性及有效性。加科思还同时计划在中国提交新药临床申请,获批后将在中美两国同步开展临床试验。
信息来源:医药观澜
赛诺菲TNFα抑制剂在中国获批临床
3月1日,中国国家药监局药品审评中心(CDE)官网公示,赛诺菲(Sanofi)1类新药SAR441566获批临床,拟开发治疗中重度类风湿性关节炎(RA)和中重度斑块型银屑病两项适应症。SAR441566是一款口服TNFα抑制剂。
信息来源:医药观澜
来凯医药ActRIIA抗体LAE102临床试验申请获NMPA受理
2024年2月29日,来凯医药宣布ActRIIA抗体LAE102的临床试验申请获得NMPA受理,用于治疗成人肥胖或代谢性疾病患者。
信息来源:医药笔记
再鼎医药引进的小分子新药获批临床
2月29日,中国国家药监局药品审评中心(CDE)官网公示,由Karuna公司申请的1类新药KarXT胶囊获得临床试验默示许可,拟开发治疗阿尔茨海默病相关的精神行为症状。这是一种潜在“first-in-class”毒蕈碱类抗精神病药物。再鼎医药拥有KarXT在大中华区(包括中国内地、香港、澳门和台湾地区)的开发、生产和商业化权益。
信息来源:医药观澜
阿斯利康CD19 × CD3双特异性疗法在中国获批临床
2月28日,中国国家药监局药品审评中心(CDE)官网公示,阿斯利康(AstraZeneca)申报的1类新药AZD0486获批临床,拟开发治疗复发性或难治性B细胞急性淋巴细胞白血病(r/r B-ALL)。AZD0486是一款靶向CD19×CD3的双特异性T细胞衔接蛋白(T-Cell Engager,TCE)。
信息来源:医药观澜
默沙东联合开发,前列腺癌1类新药在中国启动3期临床
近日,中国药物临床试验登记与信息公示平台官网公示,默沙东(MSD)和Orion公司共同登记了两项MK-5684片针对转移性前列腺癌的国际多中心(含中国)3期临床研究。MK-5684片是默沙东和Orion公司合作开发的一款口服非类固醇CYP11A1抑制剂。
信息来源:医药观澜
圣因生物siRNA药物在新西兰获批1期临床
2月26日,圣因生物宣布其自主研发的siRNA药物SGB-9768已于近日获得新西兰药品和医疗器械安全管理局(Medsafe)、健康及残疾伦理委员会(HDEC)批准,在新西兰开展1期临床试验,拟开发用于治疗补体相关疾病。SGB-9768是一款靶向补体C3蛋白的RNAi疗法,是圣因生物第2款进入临床试验阶段的siRNA药物。
信息来源:医药观澜
海和药物与大鹏药品就MET抑制剂“谷美替尼”达成授权合作
艾伯维(AbbVie)与OSE Immunotherapeutics建立战略合作伙伴关系
Viatris和Idorsia已达成全球研发合作协议
诺和诺德合作开发分子胶降解剂
恩华药业获得Teva氘丁苯那嗪片中国大陆独家商业化权益
海和药物与大鹏药品就MET抑制剂“谷美替尼”达成授权合作
3月1日,海和药物宣布和日本大鹏药品工业株式会社关于谷美替尼片(研发代码:SCC244)在日本等地区的开发、生产和商业化达成独家许可协议,该药品已经由海和药物的日本全资子公司海和制药株式会社提交日本上市许可申请。
信息来源:医药观澜
艾伯维(AbbVie)与OSE Immunotherapeutics建立战略合作伙伴关系
艾伯维(AbbVie)与OSE Immunotherapeutics宣布,建立战略合作伙伴关系,以开发旨在解决慢性和严重炎症的潜在“first-in-class”单克隆抗体OSE-230。根据协议,OSE Immunotherapeutics可能获得超过7亿美元的前期和里程碑付款。
信息来源:药明康德
Viatris和Idorsia已达成全球研发合作协议
Viatris和Idorsia联合宣布,两家公司已达成全球研发合作协议,根据该协议,Viatris将获得Idorsia两款3期项目selatogrel和cenerimod的全球独家开发和商业化权利,并可能在未来获得Idorsia其他的创新项目。根据协议条款,Idorsia的selatogrel和cenerimod开发项目和相关人员将转移给Viatris,而Idorsia将获得3.5亿美元的预付款、潜在的开发和监管里程碑等款项。
信息来源:药明康德
诺和诺德合作开发分子胶降解剂
2月26日,Neomorph宣布,已与诺和诺德达成合作许可协议,共同发现、开发和商业化心血管代谢和罕见病领域的分子胶降解剂,潜在交易总额高达14.6亿美元。
信息来源:医药魔方Info
恩华药业获得Teva氘丁苯那嗪片中国大陆独家商业化权益
2月26日,恩华药业宣布其全资子公司恩华和信与Teva Pharmaceutical(梯瓦)于2024年2月22日签署了安泰坦®(氘丁苯那嗪片)产品独家商业化许可和合作协议,恩华和信获得TEVA公司安泰坦®于中国大陆的独家商业化权益,协议期限自2024年2月22日至2029年2月22日。
信息来源:医药魔方Info
腹腔镜手术机器人公司拟上市
印度腹腔镜手术机器人公司SS Innovations International, Inc. 宣布,已申请在纳斯达克上市,并通过公开发行筹集5000万美元(约3.6亿人民币)。
信息来源:医疗器械创新网
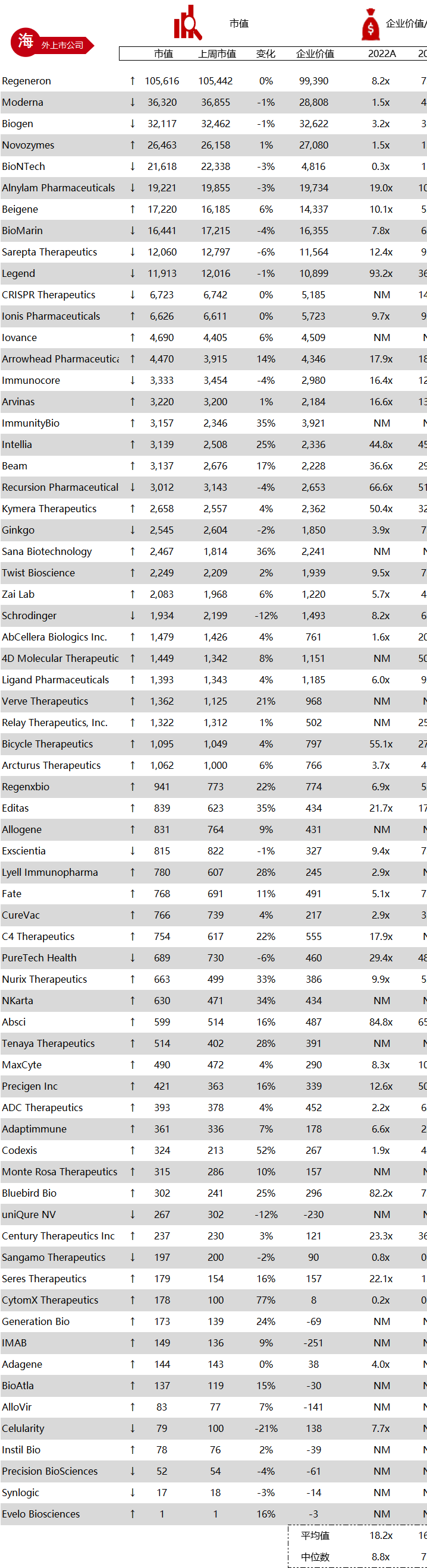
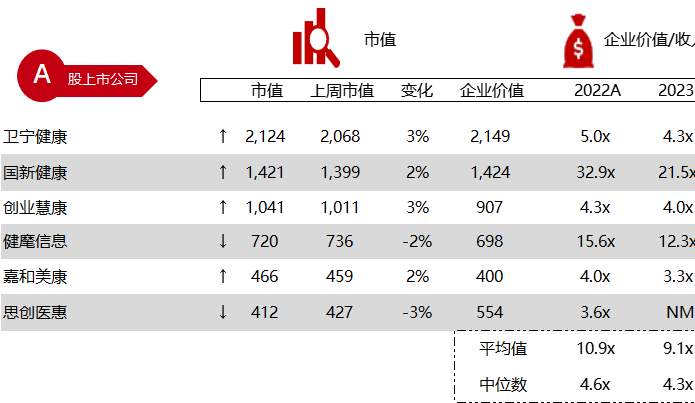
统计区间:2024年2月25日-2月29日
*数据来源:华兴资本内部整理
市值日期:2024年3月1日
市值单位:百万美元
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
< < 左右滑动图片查看完整表格 > >
*数据来源:Capital IQ、招股说明书、研报、公司年报
免责声明:本文由华兴资本集团(连同其关联公司,统称“华兴资本”)编写,谨供接收方作参考用途,并非作为也不应被视为在任何地区对任何证券的研究报告,不构成买卖、认购证券或其它金融工具及产品的邀请或保证。本文所提及的上市公司仅为示例,不代表任何投资分析或投资建议。接收方不应仅依靠本文、而应按照自己的判断作出投资决定,并在作出任何投资行动前,咨询专业意见。
本文所载资料的来源皆被华兴资本认为可靠,但华兴资本概不担保本文所含信息的准确性、完整性或新近度。本文所载的见解、分析、预测、推断和期望均截至本文的发表日期,且可能在未经事先通知的情况下调整。华兴资本与本文所提及的公司之间可能存在或寻求业务关系,因此,接收方请知悉可能存在的影响本文客观性的利益冲突。华兴资本不对因使用本文而承受的直接或间接损失承担任何责任。本文受到版权和资料全面保护。











































































精彩评论