Marizyme, Inc.宣布其旗舰产品DuraGraft™获得FDA批准。
DuraGraft™是首款且唯一获得FDA批准的医疗器械,用于冠状动脉搭桥术(CABG手术)中用作术中血管导管储存和冲洗解决方案。
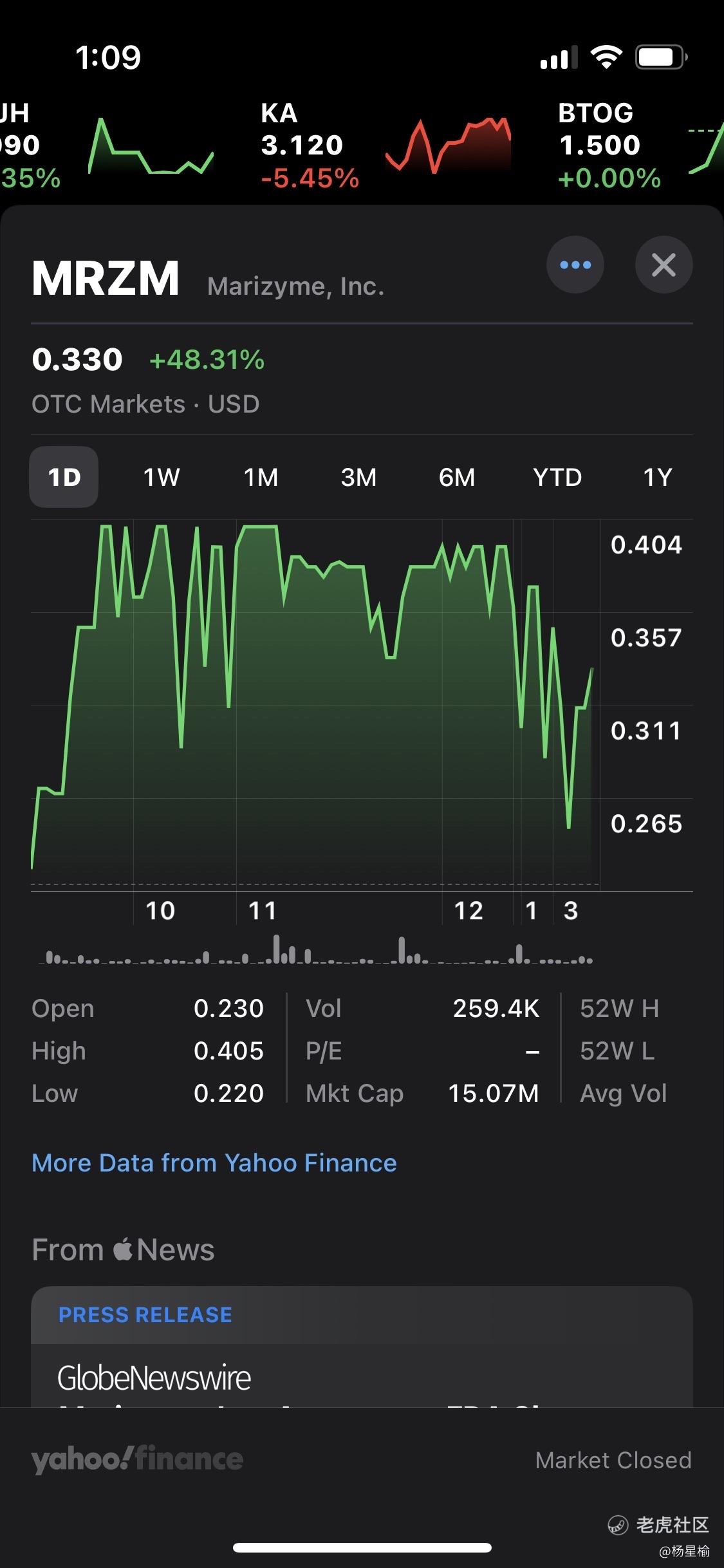
佛罗里达州,朱庇特,2023年10月06日(全球新闻社) - NewMediaWire发布 - Marizyme,Inc.(MRZM)$Marizyme, Inc.(MRZM)$ $Marizyme, Inc.(MRZM)$ $Marizyme, Inc.(MRZM)$ (以下简称"Marizyme"或"公司"),一家专注于开发产品以满足未满足临床需求的全球医疗技术公司,今天宣布其首款产品DuraGraft™获得了美国食品和药物管理局(FDA)的de novo许可。DuraGraft标明用于成年患者进行冠状动脉搭桥术(CABG手术),用于冲洗和储存CABG手术中使用的大隐静脉移植物。DuraGraft的作用机制是通过减少氧化损伤来维持血管导管的结构和功能完整性。DuraGraft在临床研究中得到了广泛研究,包括影像研究。这些研究显示,经DuraGraft处理的大隐静脉移植物在CABG手术后12个月与标准护理中的生理盐水处理移植物相比,移植物壁增厚较少。DuraGraft的使用还与CABG手术后三年内的降低长期死亡率相关联。
心脏护理是一个庞大且迅速增长的行业;根据疾病控制和预防中心的数据,冠心病的美国年均估计成本为2190亿美元。CABG手术是美国最常见的开胸手术类型,每年进行超过50万次手术。Marizyme的首席执行官David Barthel表示,DuraGraft有改变心脏护理格局的潜力。
获得de novo许可后,DuraGraft成为唯一获得FDA批准用于CABG手术中术中血管导管储存和冲洗解决方案的医疗产品,并且还是欧洲和其他国家批准用于此适应症的唯一产品。
DuraGraft是CABG和其他血管手术中唯一获得专利的产品。DuraGraft的专利组合正在增长,包括在全球30多个国家的已授权专利和待批申请,包括在美国、欧洲、澳大利亚、印度、阿根廷、南非、墨西哥以及几个亚洲国家获得的专利。
获得FDA de novo许可后,该公司将集中精力执行其在美国的商业化计划,并着重推动在医院综合网络中使用其自己的直销团队进行推广。
"达到了这一重要里程碑后,我们的公司Marizyme现在可以将这一突破性产品呈现给心脏外科医生和他们的CABG患者。这是一个迅速增长的市场,为Marizyme提供了实现其使命陈述并彻底改变心脏护理格局的机会。" - Marizyme,Inc.首席执行官David Barthel说。
关于Marizyme:
Marizyme是一家全球医疗技术公司,专注于开发产品以满足未满足的临床需求。Marizyme拥有多元化的产品管线组合,目前主要关注心脏护理领域的医疗技术的开发和商业化,主要通过其旗舰产品DuraGraft实现。
DuraGraft™已获得美国批准并获得欧盟和某些其他市场的批准以供使用。有关Marizyme的更多信息,请访问www.marizyme.com。
关于T&J Brothers Group:是一家私人投资公司和房地产咨询公司。该公司拥有来自多家家族办公室的大量资本,并在房地产、富裕个人和金融服务领域与众多知名企业有业务关系。
是一家私人投资公司和房地产咨询公司。该公司拥有来自多家家族办公室的大量资本,并在房地产、富裕个人和金融服务领域与众多知名企业有业务关系。
精彩评论