昨夜美股市场,关于脊髓性肌萎缩(SMA)市场的药物竞争跌宕起伏,在两家竞对的股价层面体现的淋漓尽致。
Biohaven(BHVN)由于主打管线taldefgrobep alfa在进行性脊肌萎缩症上三期临床主要终点相较安慰剂组无统计学差异,盘前大跌10%,随后迅速收回跌幅。而另外一边,对手Scholar rock(SRRK)盘前大涨30%,最后收涨26.07%。
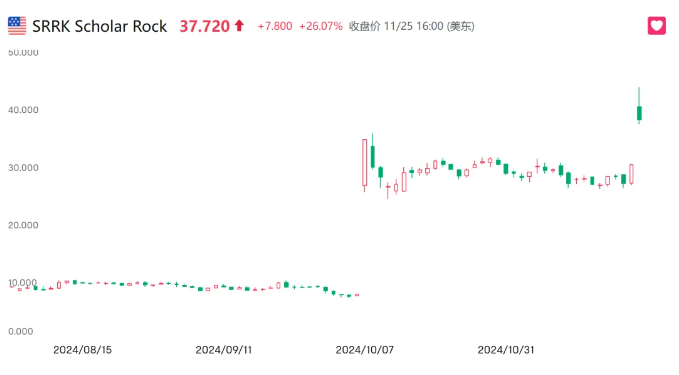
SRRK的主打产品apitegromab(SRK015)不仅两个月前SMA达到临床终点,股价直接翻了3.6倍,并且还有着下一代更加优质,亲和力更高的单抗——SRK439在准备IND。
SMA这种罕见病的数据竞争带来的催化只是ActRII通路药物的冰山一角,或许更为重要的是,两类产品在肥胖适应症上与ACTRII抗体的角逐。礼来的bimagromab是否已经抢占了绝对的先机,apitegrumab与taldefgrobep alfa是否还有与之一战的机会?
ActRII通路——对准哪个靶点
与肌肉相关的靶点中,ActRII通路是近年来备受重视的热门靶点。但这个通路,目前来看切入的靶点并不少,导致现在究竟靶谁,成为药物研发领域的主要分歧所在。
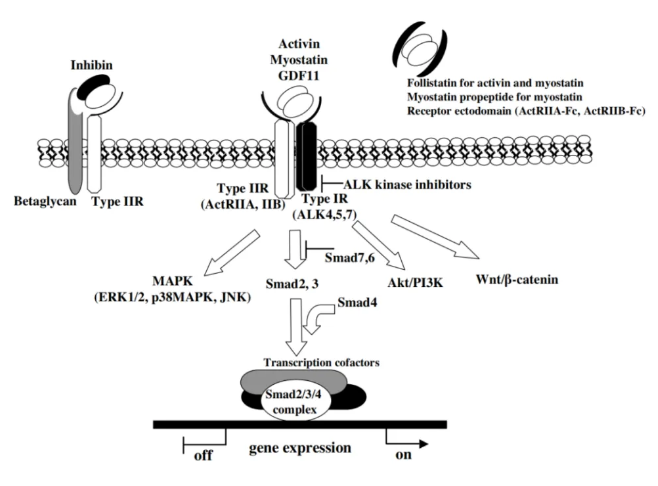
如图所示,在该通路中,ActRII被Activin,Myostatin(又称GDF-8,肌肉生长抑制素)激或者GDF-11激活,产生骨骼肌生长的负调控作用,从而抑制肌肉的生长,因此,只要能阻断它们的结合或者减少配体的数量,就能达到减少对肌肉生长的抑制,从而促进肌肉生长的效果。
但是,在该通路中,各家的思路却并不相同。ActRII受体分为两种亚型,A亚型和B亚型。目前受体单抗确实有着阻断ActRII从而促进肌肉生长的作用,但是究竟偏向哪个亚型,是目前的一个重要分歧。礼来的单抗Bimagromab主要亲和B亚型,而来凯的单抗LAE102主要亲和A亚型,目前究竟哪种思路是正确的,还没有临床数据上的验证。
除了靶向受体外,靶向配体也是一个重要的方向。目前主要的方向是靶向肌肉生长抑制素——myostatin和Activitn,其中靶向肌肉生长抑制素又分为两个方向:Biohaven的taldefgrobep alfa与再生元的Trevogrumab主要靶向成熟的肌肉生长抑制素,而Scholar Rock的apitegromab主要靶向未成熟的肌肉生长抑制素。
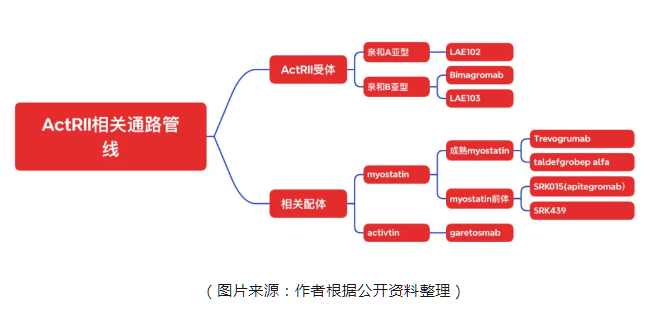
究竟哪种思路是更加正确?
配体-受体上下游方面,根据Scholar Rock的说法,靶向前体的肌肉生长抑制素可以有更高的安全性,因为并没有对其它配体产生影响,对更加上游的配体产生抑制,换来更好的专一性,继而有更好的安全性。而如果靶向下游的ActRII受体,把受体“堵住”则有可能会影响受体和其它配体的结合,影响其它通路的作用。例如如果将GDF-11敲除的话,会影响小鼠骨骼的生长,如果将受体阻断,影响GDF-11和受体的结合,会不会有同样的副作用?并不好说。
那靶向成熟的肌肉生长抑制素配体呢?根据SRK015的文献《Specific inhibition of myostatin activation is beneficial in mouse models of SMA therapy》,成熟的不同配体之间同源性较高,而配体的前体之间同源性较低,因此药物如果靶向配体前体的话,对相近的配体造成的影响会小很多。
而强A和强B两种亚型呢?目前文献来看也没有很明确的答案。从礼来的运作来看,一方面它收了Bimagromab这条管线,另一方面它给来凯的LAE102提供了临床I期的资金和技术的帮助,很明显礼来也无法保证Bimagromab的机制就一定比LAE102优秀,礼来也在“留后手”,如果之后LAE102展现了更加优异的初步临床数据,该管线被礼来BD的预期是较为稳定的。
目前相关玩家们都在抢占肥胖适应症上的先机,该通路的管线和GLP-1类药物,抑制GLP-1药物的肌肉下降成为了目前非常热门的方向。但SMA适应症上的三期临床验证,或许更应该得到当下的关注。
SMA适应症临床验证
在SMA适应症上,有一点不可否认:apitegromab是目前唯一一个在该通路上成功的SMA药物,此前SMA获批的药物有三款:诺西那生注射液、索伐瑞韦静脉输注混悬液、利司扑兰。三者都是偏基因疗法类型的药物,且跟该通路没有关系。
apitegromab确实在该疗法做到了同类药物的first in class。根据其名为Sapphire的III期临床,其主要用HFMSE的量表评分作为主要终点。有10mg/kg+标准治疗(SOC),20mg/kg+标准治疗(SOC)和安慰剂+SOC三个组。在主要终点——量表评分的改善上,10mg组的量表评分相对基线改善了2.2分,20mg组的量表评分相对基线改善了1.4分,两个组组成的总治疗组,量表评分相对基线平均改善1.8分。此外,有30%患者的HFMSE改善了3分以上,而接受安慰剂组该占比为12.5%,实现了较为明显的统计学差异。
而biohaven的taldefgrobep alfa却栽倒在了该适应症上。根据昨晚发布的公告,taldefgrobep alpha用MFM-32量表作为主要临床终点,虽然评分上,所有时间点均有临床意义上的改善;但与安慰剂+SOC组相比,治疗组在第48周的主要结果上没有统计学差异。结论已出,未来该管线的主要适应症方向将会是肥胖适应症与GLP-1联用上。
这并不是靶向成熟myostatin药物的首次失利。事实上,2018年再生元的Trevogrumab与garetosmab联用疗法此前开拓的适应症是包涵体肌炎,但在2019年,该疗法的II期临床试验被终止。
从肥胖增肌之外的适应症来看,或许配体药物之中,apitegromab的思路是正确的。在该适应症的销售额上可以参考此前上市的同适应症药物:诺西那生和利司扑兰,诺西那生2015年前后获批,上市三年达到销售峰值,超过20亿美元,利司扑兰2020年获得FDA批准,2023年的销售额16为16.46亿美元。
对于apitegromab,在该适应症上,销售峰值估测在15-20亿美元是较为合适的。
更为激烈的战场
SMA只是该类药物的开胃小菜,真正的饕餮盛宴,是和GLP-1药物联用,阻止GLP-1药物掉肌肉上。
GLP-1的肌肉流失副作用算是老生常谈的话题,根据2024年9月彭宁顿生物医学研究中心研究的数据,GLP-1 受体激动剂在36-72周内肌肉损失量将占体重减轻总量的25% - 39%,高于热量限制或正常衰老速度。礼来解决该方法的问题,是联用其它的增肌药物,从而抵消掉GLP-1激动剂导致肌肉流失的负面影响。为此,它于2023年收购了versnais,为了得到bimagromab这条管线。bimagromab目前的临床数据主要体现在伴有肥胖的糖尿病患者上。
根据其II期临床的数据,75名患者1:1分配接受bimagromab单药和安慰剂治疗,主要终点为脂肪含量的下降。最后治疗组的脂肪含量下降20.5%,而安慰剂组脂肪含量下降0.5%。
此外,增肌常用的指标为瘦体重(lean mass)变化。瘦体重为全身体重减去脂肪重量的体重。在瘦体重的变化上,治疗组在48周后增加了3.6%,而安慰剂组下降了0.8%。从单药的二期临床来看,该药确实有较为明显的增肌减脂作用,目前该药正在进行名为BELIEVE的临床IIb期试验,与司美联用,观察能否对肌肉流失进行有效的抑制。
此外,礼来并没有完全all in bimagromab单条管线,它目前也在与再生元合作推进Trevogrumab与garetosmab联用针对肥胖适应症的II期临床,并且与来凯进行了LAE102相关的合作,帮助其开展在美国的I期临床。
礼来对bimagromab完全自信吗?目前来看并不是,来凯目前在优先推进LAE102而非LAE103,足以看出其对强A亚型方向的信心,该信心给了其与礼来谈判的底气。这次礼来和来凯的合作,乐观些可以看做该条管线BD的“预定”。
此外,SRRK也在尽全力推进apitegromab的肥胖适应症进度,其与司美或替尔泊肽二期临床顶线数据将会在2025年二季度读出。
图片(图片来源:SRRK官网PPT)
此外,SRRK在该领域未来大概率靠的并不是apitegromab,而是它后续的潜在best in class药物——SRK439,SRK439和apitegromab,都是靶向myostatin前体,但是该药的较apitegromab亲和力提高了10倍以上,在临床前的小鼠试验中,该药物初步展现了其优越的疗效。
如图为在小鼠试验中,药物与0.04mg/kg司美格鲁肽联用的数据,其由于亲和力的原因,更小的剂量便能起到非常差异化的效果(0.3mg/kg),ActRII抗体需要20mg/kg的剂量效果才能得到SRK-439在1mg/kg剂量下的效果。
SRK439将会在明年年中申报IND,潜在的best in class,蓄势待发。
此外,taldefgrobep alpha也在进行着减重方向的II期临床。几家的目标都出奇的一致。
除了卷疗效外,剂型也是值得关注的方向,司美本身是皮下注射和口服,如果相关增肌药物设计为静脉注射未免不太方便。目前来凯的LAE102一开始便设定为皮下注射,bimagromab一开始是静注,但IIb期临床给出的注射方式换成了皮下。但apitegromab还没换,从PPT中披露的四周一次的给药周期来看,大概率仍为静脉注射。
从注射方式来看,LAE102和bimagromab处于非常领先的状态。
结语:SMA三期临床照出了同一同路不同靶向药物的真实效果,这一效果的意义不仅在于评估未来SMA适应症未来的市场竞争格局,更在于评估未来增肌减脂适应症上,能够搭上GLP-1的快车切下多大的蛋糕。目前只是这场长跑的片头曲,还远没有到高潮阶段。
精彩评论